![]()
|
"Laudato si', mi' Signore, per frate focu, San Francesco, "Il Cantico delle Creature" |
.
1.1 Le variabili termodinamiche
In Termodinamica si fa uso di svariati concetti già noti dalla Meccanica, ma sarà bene ridefinirli ora secondo le nostre necessità.
a) MASSA m. La massa di un sistema termodinamico rappresenta la somma delle masse di tutte le particelle che lo compongono. Noi ci limiteremo a considerare sistemi a massa costante, per cui normalmente non la prenderemo in considerazione. Naturalmente le sue unità rispettivamente nel S.I. e nel C.G.S. sono il chilogrammo e il grammo.
b) NUMERO DI MOLI n. Si sa che, in base al teorema di Avogadro, una quantità di materia pura (cioè diversa da un miscuglio di diverse sostanze), la cui massa in grammi è pari al peso molecolare, contiene sempre lo stesso numero di molecole. Tale numero è detto numero di Avogadro: NAV = 6,023 x 1023 molecole.
In chimica risulta perciò conveniente esprimere la massa di un sistema come multiplo di una massa in grammi pari al suo peso molecolare. Infatti, quando due sostanze reagiscono tra loro, ogni molecola dell'una reagisce con un numero definito di molecole dell'altra, e quindi le masse delle sostanze che entrano nelle reazioni risultano multipli interi delle masse suddette.
Def. 1.1: Dicesi mole o grammomolecola di una sostanza la quantità di materia la cui massa in grammi è pari al suo peso molecolare. Viene indicata con il simbolo mol.
Ad esempio, si consideri la reazione chimica 2 H2 + O2 → 2 H2O. Ciò significa che due moli di idrogeno gassoso reagiscono con una mole di ossigeno gassoso (la cosiddetta "miscela tonante", perchè la reazione è fortemente esoergonica) a due moli di acqua liquida.
c) VOLUME V. È l'estensione geometrica della porzione di spazio che è contenuta dentro la frontiera del sistema. Le unità di misura principali sono il m3, il cm3 ed il litro (pari a un dm3).
d) PRESSIONE P. È la forza per unità di superficie esercitata sulle pareti del sistema termodinamico. Si può a buon diritto parlare di "pressione del sistema" solo se la pressione idrostatica al suo interno è uniforme; se varia da punto a punto, non si può parlare in generale di "pressione del sistema", ma solo di "pressione locale". Le leggi della meccanica ci dicono che in un fluido in equilibrio sotto l'azione di un campo di forze per unità di volume, indicate con FV, la pressione idrostatica varia secondo la legge:
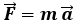
Tuttavia, per sistemi gassosi non troppo estesi (diversi ad esempio da nebulose), l'effetto delle forze di volume è trascurabile, e quindi all'equilibrio la pressione è uniforme su tutto il sistema.
Quali le unità di misura della pressione? Nel S.I. si usa il Pascal, pari alla forza di 1 Newton su un metro quadrato. Siccome però si tratta di un'unità molto piccola, è ancora assai invalso l'uso dell'atmosfera, pari alla pressione atmosferica s 45° di latitudine, a 0°C e al livello del mare. 1 atm equivale a 101.325 Pa. Esiste anche il bar, pari a 105 Pa. In meteorologia si utilizza il millibar, pari a 100 Pa, sostituito dall'ettoPascal (hPa) da quando l'Unione Europea ha stabilito di rinunciare alle unità non S.I. Un'atmosfera è pari a 1033 millibar. Come si evince dal famoso esperimento di Torricelli, un'atmosfera è pari alla pressione di una colonna di mercurio alta 760 mm, e quindi equivale a 760 torr, dove un torr è pari alla pressione di un millimetro di mercurio; un torr è pari a circa 133 Pa. Un tempo era utilizzata dagli ingegneri anche l'atmosfera tecnica, indicata con il simbolo ata e pari a 98.000 Pa.
Questo famoso dipinto di Salvador Dalì (1904-1989), intitolato "Galatea delle sfere" e dipinto nel 1952, mostra la mitologica ninfa Galatea rappresentata con le sembianze di Gala, la compagna del pittore, e scomposta in un apparentemente misterioso reticolo di sfere. Dalí si interessò alla fisica atomica dopo l'esplosione di Hiroshima nell'agosto 1945, e descrisse l'atomo come « il mio cibo preferito per la mente ». Dopo aver scoperto che la materia è composta da atomi che non si toccano l'un l'altro, cercò di replicare questa realtà nella sua arte, dipingendo gli oggetti sospesi e non a contatto tra di loro, come nella celebre "Madonna di Port Lligat". Questo dipinto è il simbolo del suo tentativo di conciliare l'arte rinascimentale con la teoria atomica, e secondo me rappresenta nel modo più efficace possibile la discontinuità intima della materia, sulla quale si basa per intero la moderna Termodinamica.
.
1.2 L'equilibrio termodinamico
Def. 1.2: Si dice che un sistema si trova in equilibrio termodinamico quando le sue proprietà macroscopiche, espresse in termini di variabili termodinamiche, non variano nel tempo.
Affinché ciò possa avvenire, occorre che siano soddisfatte determinate relazioni tra le variabili del sistema e le condizioni ambientali, e che siano verificate le equazioni di stato che esprimono l'equilibrio tra le diverse parti del sistema. Quando le condizioni ambientali variano, oppure si produce qualche perturbazione interna al sistema, si manifestano alterazioni delle variabili del sistema, tanto più rapide quanto maggiore è l'entità dello squilibrio che le ha procurate. Tale processo, che si conclude in genere con il raggiungimento di un nuovo stato termodinamico, prende il nome di trasformazione termodinamica.
Dal punto di vista tecnico, rivestono particolare importanza le trasformazioni che si concludono con il ritorno del sistema alle condizioni di partenza. Si parla in tal caso di trasformazioni chiuse o di cicli. Esse in teoria possono essere ripetute indefinitamente; siccome la ripetizione del ciclo può produrre grandi quantità di lavoro, si intuisce che le macchine energetiche sono basate su questo principio, come vedremo a suo tempo.
Uno stato di equilibrio è dunque caratterizzato da due precisi parametri termodinamici, che agiscono da variabili indipendenti. Si intuisce che esso può essere adeguatamente rappresentato in un piano con due assi coordinati: P e T, o V e T, o P e V. Quest'ultimo è il più importante, ed è chiamato piano P-V o Piano di Clapeyron, dal nome dell'ingegnere francese Paul Émile Clapeyron (1799-1864) che lo ideò. Più avanti introdurremo il Piano T-S o Piano di Gibbs. Ogni punto del piano P-V rappresenta dunque uno stato di equilibrio del sistema; se infatti il sistema non si trova all'equilibrio, non si possono definire in modo preciso i suoi parametri termodinamici, e tale situazione non è di conseguenza rappresentabile nel piano di Clapeyron. Ciò comporta che le trasformazioni termodinamiche reali non sono rappresentabili su tale piano.
Tenendo
presente tale concetto, pensiamo ad una massa gassosa contenuta dentro uno
stantuffo mobile, cioè dentro un cilindro con
coperchio mobile. L'equilibrio termico del sistema richiede che:
i) la pressione P sia uniforme in tutto il gas;
ii) sia verificata l'equazione P = F/S, dove F è la forza
esercitata sullo stantuffo di area S, supposta piana e normale ad F.
Una variazione di F produce un movimento dello stantuffo; durante il moto la pressione non è più uniforme, perchè mentre gli strati di gas più prossimi allo stantuffo già modificano le loro condizioni, quelli più distanti ancora non risentono della perturbazione, che si propaga nel gas a velocità finita. Dunque, se all'equilibrio le condizioni del sistema erano correttamente individuate dal volume e da un valore univoco di pressione, durante la trasformazione oltre al volume occorrerebbe conoscere i valori dell'intero campo di pressioni, variabile da punto a punto! Dunque, queste trasformazioni non si possono rappresentare nel piano di Clapeyron. A meno che...
A meno che ogni singolo passaggio intermedio della nostra trasformazione, corrispondente ad ogni valore del volume, non rappresenti a sua volta uno stato di equilibrio del nostro sistema. Questo però può essere ottenuto solo se la trasformazione del sistema è lentissima, in modo tale da potersi avere delle variazioni continue della pressione, senza che essa subisca variazioni da punto a punto all'interno dello stantuffo. Al limite, quando la velocità della trasformazione tende a zero, si può pensare che tutti gli stati intermedi della trasformazione restino all'equilibrio, e che quindi la trasformazione sia rappresentabile come una linea continua nel piano P-V, come si vede in figura.
Ci si rende conto facilmente che, ai fini pratici, tale limite risulta assai spesso facilmente raggiungibile, senza commettere un errore grandissimo. Infatti, tornando all'esempio dello stantuffo, basta che la sua velocità risulti bassa rispetto alla velocità di propagazione della perturbazione (cioè rispetto alla velocità del suono) perchè la pressione, pur variando nel tempo, si possa ritenere pressoché uniforme nel cilindro, entro i limiti degli errori di misura.
Def. 1.3: Siccome si può pensare che una trasformazione fatta di successivi stati di equilibrio si possa percorrere in entrambi i sensi, le si dà il nome di trasformazione reversibile. In realtà si tratta di una trasformazione degenere, in quanto infinitamente lenta e senza attriti né squilibri interni o esterni. L'interesse di queste trasformazioni consiste nel fatto che esse sono le uniche di cui si può fornire una descrizione matematica. Infatti, se X ed Y sono le variabili atte ad individuare lo stato, la trasformazione è rappresentabile con l'equazione:
f ( X ; Y ) = 0
Def. 1.4: Si dicono invece quasi-statiche le trasformazioni reali a cui si ritiene di poter applicare, con errore trascurabile, le equazioni a rigore valide per le sole trasformazioni reversibili.
Def. 1.5: Dicesi isobara una trasformazione durante la quale la pressione resta costante. Ad esempio, è tale una trasformazione che avviene in uno stantuffo con un peso costante sopra di esso. Nel piano di Clapeyron è rappresentata da una retta orizzontale.
Def. 1.6: Dicesi isocora (o isovolumica) una trasformazione durante la quale il volume resta costante. Ad esempio, è tale una trasformazione che avviene entro un contenitore a pareti rigide. Nel piano di Clapeyron è rappresentata da una retta verticale.
Def. 1.7: Dicesi isoterma una trasformazione che avviene a temperatura costante (della temperatura daremo una definizione operativa nel § 1.4). Questa è la più difficile da realizzare, come vedremo nel seguito, a meno che non si realizzi durante una transizione di fase; si parla in tal caso di isotermobarica.
Def. 1.8: Dicesi adiabatica una trasformazione che avviene senza scambio di calore. Ciò avviene ad esempio se lo stantuffo ha pareti adiatermiche, come il doppio strato di vetro riflettente di un thermos.
.
1.3 Il Principio Zero della Termodinamica
Abbiamo detto che un sistema si trova all'equilibrio termodinamico quando può permanere indefinitamente in tali condizioni, senza che si manifestino alterazioni nelle sue variabili di stato. L'assenza di mutamenti nelle proprietà microscopiche non implica però che siano immobili tutte le particelle che costituiscono il sistema. Le condizioni per l'equilibrio termodinamico non sono dunque così vincolanti come le condizioni per l'equilibrio meccanico microscopico, che richiederebbe l'annullarsi della risultante di tutte le forze in ciascuna microparticella. Tuttavia, l'equilibrio termodinamico è soggetto ad alcune condizioni, esprimibili in termini di relazioni tra le variabili microscopiche:
equilibrio meccanico macroscopico
equilibrio termico
equilibrio chimico
Trascuriamo ora la prima e la terza condizione, e parliamo solo dell'equilibrio termico. Se accosto due corpi e li lascio l'uno accanto all'altro, si manifestano variazioni di stato anche in assenza di azioni meccaniche visibili o di reazioni chimiche. Ecco alcuni esempi:
se immergo in acqua bollente un termometro, la colonnina di mercurio sale anche se l'acqua non esercita su di esso alcuna trazione;
se si mette sul fuoco una pentola piena d'acqua, questa si trasforma in vapore, bolle e le bolle subiscono moti di convezione che eseguno un'azione meccanica, per esempio sui maccheroni gettati in essa, benché le pareti rigide della pentola "proteggano" l'acqua da ogni azione meccanica da parte dei gas sprigionati dalla fiamma;
se si misura la differenza di potenziale elettrico ai due capi di due fili metallici di diversa composizione saldati agli estremi opposti, prima tenendo la saldatura immersa in azoto liquido e poi in acqua bollente, i risultati sono completamente diversi!
Effetti come quelli sopra descritti sono dovuti a moti invisibili delle particelle microscopiche di cui i diversi corpi sono composti. Tutti hanno in comune la caratteristica di verificarsi a seguito del contatto di corpi capaci di trasmettere, se toccati, le sensazioni fisiologiche che siamo abituati a classificare come "termiche", cioè di caldo e freddo. Naturalmente, a noi occorre stabilire dei criteri quantitativi, e non soggettivi come le impressioni fisiologiche.
Def. 1.9: Si dice che due corpi sono in equilibrio termico tra di loro se, una volti posti a contatto, non si verificano trasformazioni termodinamiche, se non quelle dovute a forze esercitate a livello macroscopico.
C'è poi un fatto importantissimo, di natura meramente sperimentale, che ci aiuta a caratterizzare operativamente le condizioni di equilibrio termico. Questo fatto è talmente basilare che si suole indicarlo con il nome di...
PRINCIPIO ZERO DELLA TERMODINAMICA: ogni qualvolta che due corpi A e B sono in equilibrio termico separatamente con un terzo corpo C, sono anche in equilibrio termico tra di loro.
Questo vuol dire che se l'acqua di un bicchiere è in equilibrio termico con il bicchiere, e questo lo è con l'ambiente circostante, acqua ed ambiente sono in equilibrio tra di loro. Dunque, per sapere se A e B sono in equilibrio tra di loro, non è necessario porli a contatto diretto; al posto del corpo C si può usare uno strumento detto termoscopio, atto a classificare gli stati di equilibrio termico, purché C subisca delle modifiche vistose al cambiare del suo stato termico. Allo scopo, si può usare un tubicino di vetro contenente mercurio. Siccome il mercurio si dilata a contatto con il calore, così come tutti i corpi, nel caso in cui io lo immerga in un recipiente A e poi in un recipiente B, ed in entrambi in casi la dilatazione è la stessa, grazie al Principio Zero si può affermare che A e B sono in equilibrio tra di loro, ovviamente nei limiti degli errori sperimentali.

Anders Celsius su di un francobollo svedese
.
1.4 Scale termometriche e la dilatazione termica
A questo punto possiamo procedere alla definizione operativa di una variabile termodinamica associata agli equilibri termici. Basta introdurre un indice di stato, operativamente rappresentato dalla lunghezza della colonnina di mercurio. Se l'indice è uguale nei due casi, diremo che i due corpi si trovano in isotermia, ovvero che hanno la stessa temperatura. Se l'indice di A è maggiore di quello di B, significa che "A è più caldo di B", cioè che si trova a temperatura maggiore, e viceversa. Il termine "temperatura" deriva dalla "tempra" dei metalli, che veniva effettuata immergendoli ancora incandescenti in acqua appunto alla giusta temperatura per conferire loro una resistenza meccanica maggiore.
Lo strumento da noi ideato a questo scopo prende il nome di termometro, e fu ideato nel 1714 dal tedesco Daniel Fahrenheit (1686-1736), che come fluido usò il mercurio. Oggi allo scopo si usano anche termocoppie e termoresistenze, ma su di esse non ci soffermiamo. Fahrenheit osservò che il ghiaccio fondente e l'acqua bollente mantengono costante la loro temperatura, per cui usò questi due stati per tarare il proprio termometro: chiamò 32° la temperatura del ghiaccio fondente, 212° quella dell'acqua bollente, e divise l'intervallo così stabilito in 180 unità dette gradi. Questa si chiama Scala Fahrenheit, ed è tuttora in uso nei paesi di lingua anglosassone. Nel 1742 lo svedese Anders Celsius (1701-1744) decise di semplificare le cose, chiamando 0° la temperatura del ghiaccio fondente, 100° quella dell'acqua bollente e dividendo l'intervallo in 100 unità dette gradi centigradi (°C), oggi i più usati nel mondo. Una terza scala, ideata nel 1732 dal francese René-Antoine Ferchault de Réaumur (1683-1757), basatosi sulla dilatazione dell'alcool, poneva 0° la temperatura del ghiaccio fondente e 80° quella dell'acqua bollente, ma oggi è caduta in disuso.
Come passare dalla scala centigrada a quella Fahrenheit e viceversa? Sia t°C una temperatura centigrada e t°F la corrispondente temperatura Fahrenheit. Alla differenza di temperatura ( t°C – 0 ) corrisponde nell'altra scala la differenza ( t°F – 32 ). E siccome 100 gradi Celsius equivalgono a 180 gradi Fahrenheit, basterà eseguire la proporzione:
( t°F – 32 ) : t°C = 180 : 100
Da cui si ricava la formula:
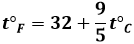
e la corrispondente inversa:
![]()
Esempio 1.1: Se t°C = 37° (la temperatura del corpo umano sano), si ricava facilmente t°F = 98,6°F. Vogliamo invece trovare qual è la temperatura che assume lo stesso valore numerico nella Scala Celsius e in quella Fahrenheit. Basterà risolvere l'equazione:
![]()
da cui si ricava t°C = t°F = – 40°. Per passare invece dalla Scala Celsius a quella Réaumur è viceversa bisogna invece usare la proporzione:
t°C : t°R = 100 : 80
Una quarta scala termometrica, quella assoluta, la presenteremo tra poco.
Il funzionamento del termometro è basato, come si è visto, sul fenomeno della dilatazione termica delle sostanze. Dal punto di vista intuitivo, tale dilatazione avviene perchè le molecole della sostanza ad alta temperatura si muovono più velocemente, e quindi occupano uno spazio maggiore. Ma quale legge fisica regola questo fenomeno? Diamo la...
Def. 1.10: Si dice coefficiente di dilatazione termica (o cubica) di una sostanza a pressione costante il rapporto:
![]()
Essa equivale a dire che, in seguito a una variazione di temperatura Δt°, quella sostanza subisce una variazione di volume ΔV pari a:
ΔV = β V Δt°
e quindi, detto V0 il volume a 0°C, il volume V a temperatura t° è dato da:
V = V0 + ΔV = V0 + β V0 ( t° – 0° ) = V0 ( 1 + β t° )
Per le sostanze in cui una dimensione prevale sulle altre (ad es. una sbarra di metallo), la dilatazione in quella dimensione prevale nettamente sulle altre ed è l'unica sensibile. Se l è la lunghezza della sbarra, introdurremo allora il concetto di coefficiente di dilatazione lineare λ:
![]()
Da cui Δl = λ l Δt°, e quindi, detta l0 la lunghezza a 0°C, avremo:
l = l0 + Δl = l0 + λ l0 ( t° – 0° ) = l0 ( 1 + λ t° )
λ, come β, si misura in °C–1. Per misurarlo è possibile utilizzare ad esempio lo strumento raffigurato qui sotto e chiamato dilatometro, che consiste in un fornelletto ad alcool disposto in modo da arroventare una sbarretta di metallo intercambiabile; quando questa si allunga in seguito al fenomeno della dilatazione termica, muove una lancetta lungo una scala graduata, che permette di misurare l'allungamento con estrema precisione.

Ecco i valori di λ per alcune sostanze, in ordine decrescente:
|
Sostanza |
°C–1 |
|
mercurio |
18 x 10–5 |
|
zinco |
30 x 10–6 |
|
piombo |
29 x 10–6 |
|
stagno |
27 x 10–6 |
|
alluminio |
24 x 10–6 |
|
argento |
19 x 10–6 |
|
rame |
17 x 10–6 |
|
oro |
15 x 10–6 |
|
acciaio |
12 x 10–6 |
|
platino |
9 x 10–6 |
|
silicio |
8 x 10–6 |
|
tungsteno |
5 x 10–6 |
Esempio 1.2: una rotaia di ferrovia d'acciaio lunga 18 m alla temperatura di 0°C. Qual è la sua lunghezza alla temperatura di 40°C, sotto il cocente sole estivo? Basta applicare la formula precedente e si ha:
l = 18 x ( 1 + 12 x 10–6 x 40 ) = 18,009 m
Dunque l'allungamento è di 9 mm. Questo spiega perchè le rotaie dei treni non sono mai l'una contigua all'altra, ma tra di esse è lasciato uno spazio: se così non fosse, le rotaie dilatandosi si piegherebbero, causando il deragliamento del treno.
Tutti i corpi si dilatano con il calore, tranne uno: l'acqua, tra 0° e 4°C, che tende a contrarsi; ed infatti la massima densità dell'acqua si ha a 4°C, come mostra il diagramma seguente, che ha in ascisse la temperatura in °C e in ordinate la densità in Kg/dm3:
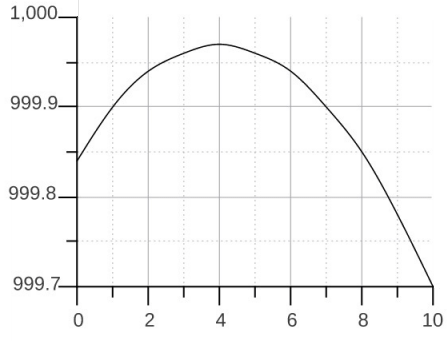
In altre parole, il ghiaccio d'acqua ha un volume maggiore dell'acqua liquida, e le cause di questo fatto le esporremo più avanti, nel capitolo 7. L'esistenza della vita sulla Terra dipende proprio da questa circostanza: se infatti l'acqua si comportasse come tutte le altre sostanze, gli oceani comincerebbero a ghiacciare dal fondo. Evidentemente questo è un esempio di "List der Vernunft" ("astuzia della ragione"), come la chiamava il filosofo Georg Hegel nei suoi "Lineamenti di filosofia del diritto"!
E se il corpo è compresso, anziché farlo dilatare? Aggiungiamo altre due definizioni:
Def. 1.11: Si dice modulo di comprimibilità isoterma di una sostanza il parametro:
![]()
Esso si misura in Pa–1. Il segno meno è giustificato dal fatto che, al crescere di P, V in ogni caso diminuisce, e quindi la variazione di volume è negativa. Il segno meno elimina questa ridondanza.
Def. 1.12: Si dice modulo di comprimibilità adiabatica di una sostanza il parametro:
![]()
calcolato in condizioni adiabatiche, cioè quando non vi è alcuno scambio di calore. Anch'esso si misura in Pa–1. Osserviamo en passant che la propagazione di onde elastiche in un corpo è un fenomeno adiabatico; si può dimostrare che la velocità del suono vS nei corpi solidi è data dalla formula:
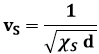
dove d è la densità del corpo.
Esempio 1.3: l'aria a 15°C e a 1 atm di pressione ha una densità di 1,225 Kg/m3 e un modulo di comprimibilità adiabatica pari a 7 x 10–6 Pa–1. Sostituendo questi dati nella precedente si trova vS = 340 m/s, che coincide con il valore comunemente accettato della velocità del suono nell'aria. È evidente che, più il corpo è denso, più è difficile farlo vibrare, e dunque minore è la velocità del suono. Inoltre, vS dipende solo dalla temperatura assoluta alla quale il corpo si trova. Di questo argomento riparleremo ancora nel § 8.6.
.
1.5 La quantità di calore
Entriamo ora davvero nel vivo della Termodinamica, presentando la grandezza più importante di cui essa si occupa nei suoi calcoli: il calore. Abbiamo visto che, avvicinando tra di loro due corpi a diversa temperatura (ad es. una pentola d'acqua e la piastra della cucina economica) avvengono dei fenomeni di interazione di tipo non meccanico a livello microscopico, che si manifestano in vari modi: allungamenti, dilatazioni, moti convettivi, cambiamenti di stato, eccetera. Questo significa che è avvenuto un trasferimento di "qualcosa" da un corpo all'altro. Questa quantità viene operativamente definita quantità di calore o, più semplicemente, calore.
Una definizione operativa richiede uno strumento di misura che permette di definire univocamente la quantità in gioco. Questo strumento è chiamato calorimetro ed è raffigurato qui sotto. Il tutto è contenuto tra pareti adiabatiche. Si tratta di un termostato, cioè di uno strumento in grado di mantenere costante la temperatura al suo interno. Ciò avviene grazie all'utilizzo di un vaso Dewar, un contenitore con pareti doppie di vetro riflettente tra le quali è praticato il vuoto, per mantenere il calore dentro di esso; il vaso Dewar prende il nome dal fisico e chimico britannico James Dewar (1842-1923), che lo ideò nel 1892. Il coperchio del calorimetro, anch'esso adiabatico, comprende un agitatore, utilizzato per rimescolare il calore al suo interno, e un termometro il cui bulbo pesca all'interno del vaso Dewar. Quando si inserisce un corpo caldo nel calorimetro, la temperatura misurata dal termometro aumenta; l'aumento di temperatura è un indice del passaggio di calore avvenuto tra il corpo caldo appena inserito e il fluido già presente nel calorimetro.
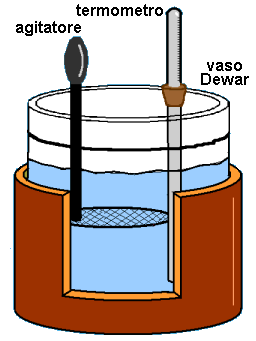

Def. 1.13: Si dice caloria la quantità di calore necessaria affinché la temperatura di 1 grammo di acqua salga di 1°C, da 14,5°C a 15,5°C. Invece la quantità di calore necessaria per far subire lo stesso innalzamento di temperatura ad 1 Kg di acqua si dice chilocaloria o "grande caloria". In pratica, il numero di grammi d'acqua contenuti nel calorimetro ideale appena descritto esprime il numero di calorie che fluisce.
È però facile rendersi conto dell'importante fatto che la quantità di calore scambiata da un sistema durante una trasformazione non dipende solo dagli stati iniziale e finale, ma da tutta quanta la trasformazione. Allo scopo, travasiamo la stessa acqua del calorimetro precedente nel dispositivo sottostante, noto come mulinello di Joule. Esso è costituito da un calorimetro alle cui pareti interne sono fissate delle palette, mentre attraverso il coperchio passa un perno cui sono saldate delle palette in grado di ruotare; il perno passa attraverso una guarnizione di gomma per minimizzare le perdite di calore. Nel perno è inserita anche una carrucola, a cui sono avvolti dei cavi; ad essi sono collegati delle masse m. Facendo cadere queste ultime, si mette in moto il perno, le cui palette mobili fanno ruotare l'acqua; l'attrito di questa contro le pareti e contro le palette fisse, solidali con le pareti interne, la fa scaldare, come rivela il termometro incorporato, come se la avessimo messa a contatto con un corpo caldo.
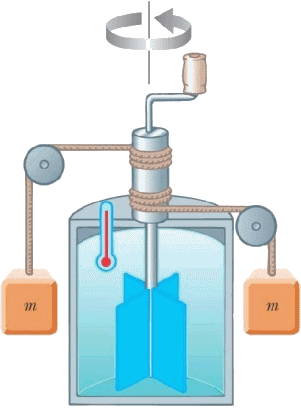
Questa circostanza conduce a due importantissime conclusioni:
1) La quantità di calore Q NON è una funzione di stato, poiché non dipende dallo stato del sistema ad un dato istante, ma da una ben precisa trasformazione che conduce a un riscaldamento o a un raffreddamento del corpo. Per questo, se adoperiamo gli strumenti dell'Analisi Matematica, la quantità infinitesima di calore non potrà essere indicata con la scrittura dQ, bensì con la notazione d*Q, trattandosi di un differenziale non esatto.
2) L'esperienza del mulinello di Joule permette anche di determinare il cosiddetto equivalente meccanico della caloria. Joule stabilì infatti che la caduta di una massa da 1 Kg dall'altezza di circa 427 metri faceva innalzare l'acqua del suo dispositivo, la cui massa totale era pari a 1 Kg, di 1°C, per cui una caloria equivale all'energia di:
427 m x 1 Kg x 9,8 m/s2 = 4186 J
Questo significa che la caloria può essere riguardata come un'unità di misura dell'energia, identificando:
1 Kcal = 4186 J
È aperto il dibattito, tra gli studiosi, se il calore sia una forma di energia, detta energia termica in contrapposizione all'energia meccanica, o piuttosto un modo con il quale l'energia si trasmette. Noi semplificheremo le cose parlando del calore come di una forma di energia, anche se vedremo che si tratta di una qualità per così dire "degenerata" di energia. Si parla al proposito di principio di equivalenza tra calore e lavoro.
.
1.6 I calori specifici
Se proviamo ad inerire nel calorimetro acqua o alcool etilico, ci accorgiamo facilmente che, a parità di calore ceduto al calorimetro, sono diverse le variazioni di temperatura subite da quelle sostanze. Il calore che fa innalzare di 10°C la temperatura di 1 Kg di alcool etilico è sufficiente ad innalzare solo di 5,7°C la temperatura di una uguale massa d'acqua. Questo significa che, a parità di calore assorbito, a variazione di temperatura del corpo dipende dalla natura del corpo stesso. In che misura?
Non è difficile verificare che il calore ceduto ad un corpo durante una certa trasformazione è direttamente proporzionale alla massa del sistema e alla variazione di temperatura da essa subita. La costante di proporzionalità la chiameremo c:
Q = c m ΔT (1.1)
Def. 1.14: Dicesi calore specifico cX la quantità di calore ceduta al corpo per unità di massa e di variazione di temperatura lungo la trasformazione X. Esso si misura in cal / Kg °C oppure in J / Kg °C. Esso può essere così definito:
![]()
Def. 1.15: Dicesi capacità termica CX la quantità di calore scambiata dal corpo per unità di temperatura lungo la trasformazione X. Essa si misura in cal / °C oppure in J / °C. Essa può essere così definita:
![]()
Def. 1.16: Dicesi calore specifico molare cmX la quantità di calore scambiata dal corpo per unità di variazione di temperatura e di moli lungo la trasformazione X. Esso si misura in cal / mol °C oppure in J / mol °C. Esso può essere così definito:
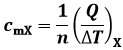
Come si vede, tutte queste grandezze dipendono dal tipo di trasformazione e dalla natura dal corpo in questione. Se però osserviamo la (1.1), ci accorgiamo subito che Q dipende a sua volta dalla temperatura, per cui cX, CX e cmX non sono affatto proporzionali, se non quando l'intervallo considerato è piccolo. Ecco ad esempio come varia il calore specifico dell'acqua con la temperatura:
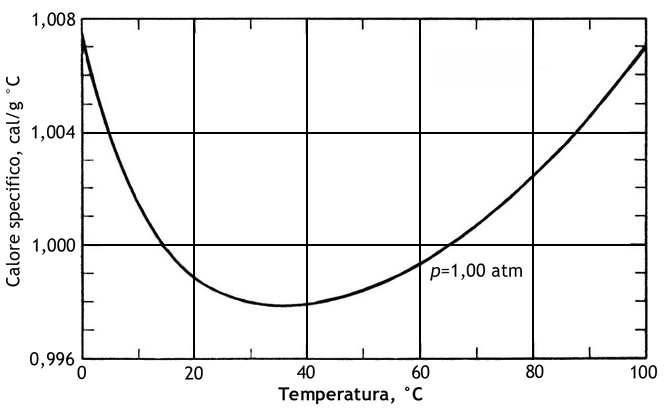
Usando gli strumenti dell'Analisi Matematica, la variazione finita ΔT va sostituita con quella infinitesima dT:
d*Q = cX m dT
In questi termini, potremo scrivere:
![]()
D'ora in poi indicheremo il calore specifico molare calcolato lungo la trasformazione isobara con cP e quello calcolato lungo una trasformazione isocora con cV, e scriveremo:
![]() ;
;
![]()
Osserviamo la tabella seguente, contenente i valori di cP per alcune sostanze in ordine decrescente:
|
Sostanza |
|
|
|
acqua |
1 |
4186 |
|
alcool etilico |
0,566 |
2370 |
|
ghiaccio (0°C) |
0,488 |
2040 |
|
vapore (100°C) |
0,464 |
1940 |
|
aria |
0,24 |
1005 |
|
alluminio |
0,22 |
896 |
|
CO2 |
0,20 |
836 |
|
ferro |
0,115 |
450 |
|
zinco |
0,095 |
389 |
|
rame |
0,093 |
385 |
|
argento |
0,06 |
239 |
|
oro |
0,03 |
129 |
Notiamo come l'acqua sia la sostanza che, a parità di calore assorbito, subisce lo sbalzo termico minore. Questo spiega perchè il clima delle località lacustri o marine è solitamente più temperato di quello continentale: l'acqua trattiene una enorme quantità di calore, che poi rilascia molto lentamente nell'ambiente circostante.
Esempio 1.4: Sia un calorimetro ideale che contiene due litri e mezzo d'acqua alla temperatura t2 = 15°C. Mescolando ad esso un litro e mezzo di acqua a t1 = 37°C, qual è la temperatura finale nel calorimetro?
È evidente che alla fine tutta l'acqua si sarà stabilita alla temperatura x°C. Il calore Q1 ceduto dall'acqua più calda, la cui massa è pari a m1 = 1,5 Kg, deve essere pari a quello Q2 assorbito dall'acqua più fredda, la cui massa è m2 = 2,5 Kg, poiché le pareti sono adiabatiche. Il primo calore è pari a m1 c ( t1 – x ), mentre il secondo è pari a m2 c ( x – t2 ), dove c è il calore specifico dell'acqua. Tuttavia, come vedremo, il calore ceduto dall'acqua calda per convenzione è negativo, mentre quello assorbito dall'acqua fredda è positivo. Dovremo perciò scrivere l'equazione:
m1 c ( t1 – x ) = m2 c ( x – t2 )
Risolvendo la quale si trova:
![]()
Da qui si ricava che, mescolando masse diverse di una stessa sostanza a temperature diverse, la temperatura finale sarà data dalla media pesata delle singole temperature, usando le masse come pesi.
Esempio 1.5: Supponiamo ora che l'esperienza suddetta venga eseguita con un calorimetro reale, e che si trovi una temperatura finale di soli 21,19°C. Questo significherebbe che parte del calore ceduto dall'acqua calda, invece di essere assorbito dall'acqua fredda, è stato assorbito dal calorimetro oppure è stato disperso nell'ambiente perchè le pareti non erano perfettamente adiabatiche. Come fare per valutare quanto calore viene dissipato? Si introduce il concetto di equivalente in acqua del calorimetro, indicato con meq e corrispondente alla quantità d'acqua che assorbe lo stesso calore assorbito dal calorimetro. Questo calore è pari a meq c ( x – t2 ), per cui l'equazione di equilibrio termico sopra scritta diventa:
m1 c ( t1 – x ) = m2 c ( x – t2 ) + meq c ( x – t2 )
Sostituendo i valori numerici si trova meq = 0,183 Kg. Questo valore può essere utilizzato per determinare sperimentalmente il calore specifico di una sostanza solida. Supponiamo di avere una massa di 500 g di alluminio che viene scaldata a 90°C a bagnomaria (in modo che il riscaldamento sia uniforme). La inseriamo nello stesso calorimetro già usato poco fa (del quale già conosciamo meq) e in cui sono già presenti 2,5 kg di acqua a 15°. Dopo aver lasciato termalizzare il tutto, si ottiene una temperatura finale di 17°,88 C. In questo caso, detta m3 la massa dell'alluminio e cAl il suo calore specifico, l'equazione di bilancio termico diventa:
m3 cAl ( t1 – x ) = m2 c ( x – t2 ) + meq c ( x – t2 )
Sostituendo i valori numerici si ricava cAl = 897 J / Kg °C: un valore molto vicino a quello contenuto nella tabella soprastante.
Esempio 1.6: Chiudiamo questo capitolo con un quesito semplice ma interessante: lo sport può provocare la febbre? Consideriamo un mezzofondista di 60 Kg di peso che corre per mezz'ora, compiendo un lavoro pari ad 8 x 105 J. Supponiamo che questo lavoro si converta tutto in calore e non venga rimosso; di quanto aumenterebbe la temperatura corporea dell'uomo?
Il calore specifico del corpo umano è approssimativamente pari a 3500 J / Kg °C. Applicando la (1.1), troviamo facilmente:
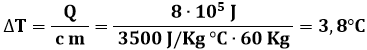
Un aumento della temperatura corporea di 3,8° porterebbe ad una febbre altissima. Per questo il corpo deve mettere in atto una serie di meccanismi atti ad eliminare il calore prodotto, tra cui uno dei principali consiste nella sudorazione. Altre specie animali, come ad esempio i felini, non sudano, ma eliminano il calore in eccesso ansimando frequentemente, come mostra il leone della fotografia sottostante.

Concludiamo sottolineando che, fin da quando eravamo bambini, ci è stato detto che la temperatura ottimale del corpo umano è pari a 37°C. In realtà questa specie di certezza matematica, alla luce delle conoscenze attuali, probabilmente va rivista. Infatti vent'anni di ricerche hanno smontato il valore di riferimento della temperatura corporea, stabilito nel 1868 dal medico tedesco Carl Reinhold August Wunderlich (1815-1877), noto per aver diffuso nella pratica clinica i termometri a mercurio. Oggi sappiamo che non vi è una temperatura ottimale per gli esseri umani e, se anche vi fosse, presumibilmente sarebbe più vicina a 36,5° che a 37°. In uno storico studio del 1992 la temperatura in 148 uomini e donne ha quotidianamente toccato il minimo a circa 36,4° verso le sei di mattina, e il massimo a 36,9° tra le sedici e le diciotto. Lo studio ha definito il limite superiore dell'intervallo normale come febbre: 37,1°C alle sei di mattina e 37,7°C alle sedici del pomeriggio. Inoltre la temperatura corporea è leggermente più alta nelle donne che negli uomini, e in media va diminuendo con l'aumentare dell'età. Nel 2002 una serie di studi diversi ha mostrato che la temperatura corporea media di uomini e donne in salute varia se è misurata in bocca, nell'orecchio o nell'intestino retto. Una conseguenza importante di questa mutata prospettiva, affermano i medici odierni, è la ridefinizione del concetto stesso di febbre. La maggior parte dei patologi la pone intorno a 38°C e anche oltre, ma se la temperatura "normale" del corpo è più bassa, allora anche la soglia della febbre dovrebbe venire abbassata di conseguenza. Dovrebbe anzi variare durante il trascorrere della giornata, ed essere personalizzata per ogni individuo: ad esempio, per un bambino 37,2° alle quattro del mattino potrebbe essere un valore anomalo, ma potrebbe essere normale alle quattro del pomeriggio.
.
E con questo, il primo capitolo è concluso! Per passare con me allo studio delle transizioni di fase, cliccate qui. Per tornare all'indice, invece, il link è questo.
![]()