

Il fatto che gli elementi abbiano tempi di dimezzamento molto diversi indica che i nuclei sono differenti l'uno dall'altro, e quindi hanno una struttura interna. Ma quale?
Uno dei primi primi problemi derivati dalla scoperta dei fenomeni radioattivi fu la necessità di sistemare nella Tavola Periodica, a quel tempo ancora con molte caselle vuote, la moltitudine di sostanze radioattive che man mano venivano scoperte. Il fatto è che alcune di esse, pur possedendo masse atomiche diverse, erano caratterizzate dalle stesse proprietà chimiche. Poiché sappiamo che le proprietà chimiche di un elemento dipendono in larga parte dal numero atomico Z, che individua il posto da esso occupato nella tavola periodica, il chimico inglese Sir Frederick Soddy (1877-1956) nel 1913 avanzò l'ipotesi che esistano diversi atomi con lo stesso numero atomico Z ma diverso numero di massa A, e li battezzò isotopi, dal greco "ἴσος", "stesso", e "τόπος", "posto", per sottolineare il fatto che essi occupano la stessa posizione nella tavola periodica. L'isotopia rivoluzionava il mondo della chimica, introducendo una discontinuità nell'idea ormai inveterata che gli atomi di una sostanza fossero tutti uguali tra di loro. Per esempio, l'elemento noto come idrogeno, univocamente caratterizzato da Z = 1, è in realtà costituito da tre diverse specie chimiche, rispettivamente con A = 1, detta anche protio, con A = 2, detta deuterio, e con A = 3, detta tritio, dalle tre parole greche che significano "primo", "secondo" e "terzo".
Tutti gli elementi oggi conosciuti sono composti da svariati isotopi, per cui ogni specie atomica è in realtà costituita da una mescolanza di isotopi diversi, molti dei quali radioattivi. Per esempio, il protio e il deuterio sono stabili, mentre il tritio è radioattivo, il che implica evidenti differenze nella struttura nucleare: una prova in più del fatto che i nuclei sono composti da particelle ancora più elementari, e comunemente dette nucleoni.
Un nucleone ha massa A = 1, cioè pari ad un'unità di massa atomica. Nel 1919 Ernest Rutherford (1871-1937) battezzò protone (dal greco "πρῶτον", "primo") la particella di carica positiva scoperta nel 1886 da Eugene Goldstein (1850-1930) e Wilhelm Wien (1864-1928) nei cosiddetti raggi anodici o raggi canale, che nei tubi a scarica viaggiano in direzione opposta ai raggi catodici. Rutherford identificò il protone con il nucleone; evidentemente però non tutte le particelle nucleari sono uguali tra di loro, dato che esistono gli isotopi, con la stessa carica nucleare ( + Ze ) ma con differenti masse atomiche.

Francobollo delle isole Maldive che raffigura James Chadwick
Il primo modello nucleare, proposto da Rutherford e Soddy, prevede che in un nucleo di massa atomica A e numero atomico Z siano presenti A protoni ed ( A – Z ) elettroni.; in tal modo, siccome un protone pesa circa un'unità di massa atomica, mentre l'elettrone in confronto ha massa trascurabile (è 1840 volte più leggero di un protone), si spiega come mai il nucleo ha massa A; siccome poi la carica totale dei protoni è pari a + A e quella degli elettroni a – A + Z, la carica totale del nucleo diventa proprio + Z. Questo schema spiega bene il decadimento beta mediante l'emissione degli elettroni provenienti dal nucleo; ogni volta che un elettrone fuoriesce, la carica nucleare sale a ( Z + 1 ), mentre la massa resta praticamente identica, e così la legge dello spostamento è salva. Però, secondo questo schema, il protio (1H) nel nucleo ha un protone e basta, il deuterio (2H) ha due protoni e un elettrone, il tritio (3H) ha tre protoni e due elettroni, per cui uno stesso elemento, l'idrogeno, viene ad avere tre possibili numeri diversi di protoni.
Questo modello resse fino al 1930, quando il tedesco Walther Bothe (1891-1957) e il suo studente Herbert Becker osservarono che delle particelle alfa generate dal polonio, incidendo su nuclei leggeri (litio, berillio, boro), generavano una radiazione particolarmente penetrante. Irène Joliot (1897-1956), figlia di Pierre e Marie, e suo marito Frédéric Joliot (1900-1958), gli scopritori della radioattività artificiale, mostrarono che questa radiazione, colpendo paraffina o altri composti fortemente idrogenati, provocava l'espulsione da essi di protoni di alta energia. I due fisici francesi proposero che si trattasse di raggi gamma, sebbene tale radiazione si mostrasse più penetrante dei raggi gamma allora conosciuti. Pare che il grande fisico siciliano Ettore Majorana (1906-?) abbia commentato in proposito: « Quei grulli hanno scoperto il protone neutro e non se ne accorgono! » Purtroppo Majorana soffriva di un complesso per cui riteneva di nessun valore tutte le sue scoperte, cosicché non pubblicò la sua intuizione. E così, nel 1932 fu l'inglese James Chadwick (1871-1974) a dimostrare che la radiazione penetrante di Bothe e Becker era formata da un secondo nucleone, leggermente più pesante del protone ma privo di carica elettrica, la cui esistenza era stata proposta più di un decennio prima, e che egli chiamò neutrone. Le masse dei due nucleoni sono:
mp
= 1,007276 amu =
1,6726 x 10–27
kg
mn = 1,008665 amu = 1,6749 x
10–27 kg
James Chadwick propose così che il numero di massa A rappresentasse il numero totale di nucleoni, mentre Z rappresenta solo il numero totale dei protoni. Nel nucleo ci sono insomma Z protoni ed ( A – Z ) neutroni. Ecco a confronto i due modelli nucleari:

Quanto ai raggi beta, come spiegarli nel nuovo modello? Inizialmente si suppose che nel nucleo fossero presenti anche degli elettroni, fino a che il grande Enrico Fermi (1901-1954) non propose la sua teoria del decadimento beta. Secondo tale teoria, un neutrone può decadere in un protone più un neutrone. In seguito, per fare in modo che fosse salvaguardata la conservazione della quantità di moto, lo stesso Fermi aggiunse che in questa reazione veniva prodotta anche una terza particella, di carica e massa a riposo entrambe nulle, che Edoardo Amaldi (1908-1989) nel 1932 battezzò scherzosamente neutrino, nome poi diventato ufficiale nella letteratura scientifica. Tale particella venne scoperta solo nel 1956 dagli americani Clyde Cowan (1919-1974) e Frederick Reines (1918-1998) nel corso di un esperimento eseguito al reattore a fissione di Savannah River (Sud Carolina). Siccome il neutrino viene indicato con ν, la reazione del decadimento beta è la seguente:
n → p+ + e– + ν
(in essa, ν è in realtà un antineutrino). Così, ogni volta che un nucleo decade beta, perde un elettrone molto energetico che se ne va, uno dei suoi neutroni diventa un protone, e così il numero di massa A resta praticamente costante, mentre Z aumenta di uno. È possibile però anche un altro tipo di decadimento beta. Infatti è possibile anche la seguente reazione:
p+ → n + e+ + ν
In essa un protone si trasforma in un neutrone, più un positrone, l'antiparticella dell'elettrone, prevista teoricamente da Paul Dirac (1902-1984) e Giuseppe Occhialini (1907-1993) e scoperto nel 1932 da Carl Anderson (1905-1991) nei raggi cosmici. La reazione produce anche un neutrino. Se avviene questa reazione, uno dei neutroni del nucleo diventa un protone, e così il numero di massa A resta praticamente costante, mentre Z diminuisce di uno. Questo nuovo tipo di decadimento viene chiamato decadimento beta più (β+), mentre il precedente è chiamato decadimento beta meno (β–). Il decadimento beta è reso possibile da una nuova interazione, chiamata forza nucleare debole, anch'essa introdotta da Enrico Fermi nel 1933. Con la forza gravitazionale, la forza elettromagnetica e la forza nucleare forte, si arriva così a un totale di quattro interazioni fondamentali.
E ora, un'avvertenza sulla nomenclatura. Ogni diversa configurazione nucleare, formata da un particolare numero di protoni e di neutroni, prende il nome di nuclide. Un nuclide caratterizzato da un numero atomico Z e da un numero di massa A, e quindi costituito da Z protoni ed ( A – Z ) neutroni, viene indicato ponendo il numero atomico in basso a sinistra e il numero di massa in alto a sinistra, così:
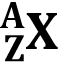
Per esempio, scrivere:
![]()
significa che questo nuclide (un isotopo dell'uranio) è formato da 92 protoni e 235 nucleoni, cioè da 235 – 92 = 143 neutroni. Se esso decade alfa, subisce la seguente reazione nucleare:
![]()
Sempre secondo la legge dello spostamento, se decade beta più diventa:
![]()
mentre se decade beta meno subisce la seguente reazione:
![]()
Quindi si trasforma in un elemento nuovo con Z = 93, il nettunio, perchè fino alle prime ricerche nucleari non si conoscevano elementi con Z > 92. Questi sono gli elementi artificiali ai quali si è già accennato, prodotti da Edwin Mattison McMillan (1907-1991) e Glenn Theodore Seaborg (1912-1999) a partire dal 1940. Il nettunio, a sua volta, può decadere beta meno e generare un elemento con Z = 94 detto plutonio, famigerato perchè, essendo un ottimo fissile, può essere usato per fabbricare ordigni atomici, oltre ad essere un potentissimo veleno chimico (l'incauta manipolazione di una sfera di 6 kg di plutonio ha procurato un'esposizione letale allo scienziato Harry Daghlian a Los Alamos il 21 agosto 1945, provocandone la morte quattro settimane dopo). E così via, vennero scoperti tutti i successivi elementi artificiali fino all'oganessio, con Z = 118, sintetizzato il 9 ottobre 2006 all'Istituto di Ricerche Nucleari di Dubna (Russia) dal fisico russo Jurij Colakovič Oganesian (1933-vivente), al quale l'elemento è stato intitolato nel 2016. Per ora nessun nuclide più pesante di questo è stato sintetizzato. I nuclidi con Z > 100 vengono comunemente definiti superpesanti.
Prima di chiudere questa lezione, aggiungiamo alcune considerazioni ulteriori circa l'effettiva struttura del nucleo atomico. Il primo modello nucleare, elaborato subito dopo la scoperta dei nucleoni, fu il cosiddetto modello a goccia ("drop model"), suggerito dalla formula:
![]()
secondo cui il nucleo ha una forma pressoché sferica; il nucleo apparirebbe insomma come una goccia d'acqua, fatta di nucleoni anziché di molecole di H2O, di forma tondeggiante, come appare ancora oggi in molte rappresentazioni artistiche dell'atomo planetario. Un modello più elaborato è quello a shell, concettualmente analogo all'atomo di Bohr. In pratica, si scrive l'equazione di Schrödinger usando come potenziale attraente quello della forza nucleare forte e come potenziale respingente quello della forza coulombiana. Ne risulta che i nucleoni si dispongono su shell (cioè su livelli energetici) ben precisi, attorno al centro delle cariche, dato che, a differenza dell'atomo, il nucleo non ha un suo "nucleo"! La prima shell contiene al massimo due protoni e due neutroni, e ciò è molto importante perchè la particella alfa corrisponde ad una shell nucleare chiusa; rappresenta quindi la struttura più stabile tra tutte quelle nucleari conosciute. Ciò spiega perchè l'energia di legame per nucleone del nucleo di elio è tanto alta, e come mai esso si comporta come una vera e propria particella. Nel diagramma dell'energia di legame per nucleone, dunque, i "picchi isolati" corrispondono a nuclidi particolarmente stabili, cioè alla chiusura delle shell nucleari, esattamente come i gas nobili rappresentano la chiusura dei livelli elettronici. In particolare, i numeri di protoni e neutroni in corrispondenza dei quali si "chiudono" le shell nucleari sono detti in gergo numeri magici, e i nuclidi che possiedono tali numeri sono detti nuclidi magici. ogni strato contiene alcuni livelli di energia ed è diviso da un altro da un “gap” di energie non permesse. Se un nucleo possiede un numero magico di protoni e/o di neutroni è necessario fornire molta energia per poter estrarre un protone e/o un neutrone da esso, mentre se si aumenta di un'unità il numero di protoni e/o di neutroni, l’energia di separazione diventa molto più piccola. I primi numeri magici sono 2, 4, 8, 20, 28, 50, 82 e 126. La particella alfa, che ha due protoni e due neutroni, è un nuclide doppio magico (è magico sia il numero dei protoni che quello dei neutroni), e ciò spiega perchè un atomo molto pesante decade emettendo questa combinazione particolarmente stabile di nucleoni e non, ad esempio, tre protoni e cinque neutroni. Anche il berillio-8 e l'ossigeno-16 sono nuclidi doppi magici, ed infatti anche ad essi corrispondono dei picchi dell'energia di legame per nucleone!

Francobollo statunitense che raffigura Maria Goeppert-Mayer
Occorre sottolineare il fatto che a studiare nei dettagli le shell nucleari e a scoprire i cosiddetti nuclidi "magici" e "doppi magici" non è stato uno scienziato, ma una scienziata, Maria Goeppert-Mayer (1906-1972), tedesca naturalizzata statunitense. Premio Nobel per la Fisica nel 1963 insieme a Johannes Hans Jensen (1907-1973), con la motivazione: « per le loro scoperte riguardanti la struttura nucleare », è stata una delle sole quattro donne premiate finora con il Nobel per la Fisica, a dimostrazione dei pregiudizi e della misoginia di chi assegna quel premio. Nata a Kattowitz in Slesia (oggi si trova in Polonia e si chiama Katowice) il 28 giugno 1906, si era laureata nel 1930 a Göttingen. Insieme al marito Joseph Edward Mayer (1904-1983), uno degli assistenti di James Franck, emigrò negli USA dove, a partire dal 1939, alla Columbia University Maria iniziò a collaborare con Enrico Fermi; dopo la guerra, i Mayer si trasferirono a Chicago, ma Maria non poté ricoprire una posizione regolare a causa delle leggi contro il nepotismo: il marito era infatti professore di chimica. Le venne offerto un impiego part-time presso l'Argonne National Laboratory (Illinois) nella divisione di Fisica Teorica: fu in questo periodo, durante il quale continuò anche il suo lavoro di volontariato presso l'Università di Chicago, che Maria diede il suo importante contributo alla fisica nucleare con il "modello a shell" della struttura del nucleo atomico. Nel 1948 Maria pubblicò un breve articolo in cui esponeva la sua teoria su "Physical Review", sicura che i "numeri magici" avessero una reale importanza per la comprensione della struttura del nucleo. Spesso discuteva con Fermi di queste sue ricerche, e lui la incoraggiava a continuare. Nella sua Nobel Lecture, Maria ricordò il supporto fondamentale del collega, così come la domanda cruciale che lui le pose nel 1949: « C'è qualche indicazione di accoppiamento spin-orbita? » Maria capì subito che era quella la risposta giusta. Enrico Fermi, nello stesso anno, dedicò al tema dei modelli nucleari una delle sue nove conferenze tenute in Italia: partendo dai limiti del modello nucleare a goccia, introdusse il modello di Maria Goeppert-Mayer, soffermandosi sulle considerazioni che avevano condotto all'osservazione dei "numeri magici". Soltanto nel 1960 Goeppert-Mayer divenne professoressa ordinaria di fisica presso l'Università della California a San Diego, dove continuò la sua attività di ricerca in fisica nucleare fino alla sua morte, il 20 febbraio 1972. Rendiamo tutti onore al lavoro di questa grandissima scienziata.
Vi è ancora molto da scoprire sui nuclidi magici e doppi magici. Ad esempio, quali sono i numeri magici per i nuclidi superpesanti che non abbiamo ancora scoperto? Alcuni prevedono un nuclide superpesante doppiamente magico con 114 protoni e 184 neutroni. L'elemento con Z = 114 è stato effettivamente sintetizzato a Dubna nel giugno 1999: si tratta del flerovio, così battezzato in onore del suo scopritore, il russo Georgij Flërov (1913-1990). Purtroppo non è stato ancora trovato alcun isotopo di flerovio con 184 neutroni, tuttavia fin dagli anni sessanta si è diffusa la leggenda (ebbene sì, anche la scienza ha le sue leggende!) che questa combinazione doppiamente magica sarebbe così incredibilmente stabile da avere un'emivita che si avvicinerebbe all'età della Terra. Questa previsione portò ad ipotizzare l'esistenza di una zona all'estremità della tavola periodica, formata da elementi superpesanti che, grazie a speciali configurazioni all'interno dei loro nuclei, avrebbero una vita media molto più lunga dei pochi microsecondi degli isotopi che finora conosciamo: si parla in proposito di isola di stabilità, e secondo alcuni essa conterrebbe anche elementi stabili. Naturalmente non sappiamo ancora se 114 e 184 sono veramente una combinazione doppio magica; altri fisici, ad esempio, prevedono una stabilità maggiore per combinazioni di 126 protoni e 172 neutroni. Che la leggenda abbia un fondo di verità, tuttavia, lo dimostra il copernicio, l'elemento con Z = 112: l'isotopo 277, con 112 protoni e 165 neutroni, vive appena per 0,6 millisecondi, mentre l'isotopo 285, con 112 protoni e 173 neutroni, ha un'emivita almeno 50.000 volte più lunga. Molto probabilmente questa tendenza continuerà mano a mano che fisici e chimici si avvicinano al centro dell'isola di stabilità, ma se esistano o meno elementi superpesanti con emivita lunghissima, o addirittura stabili, è ancora oggetto di ricerca. Che questo problema però esuli dalla ristretta cerchia dei fisici nucleari lo dimostra il film "Iron Man 2" (2010), basato sull'omonimo supereroe della Marvel. In esso Tony Stark scopre che sta per morire, perché il suo sangue è gravemente contaminato dal palladio radioattivo necessario per far funzionare il reattore a fusione nel proprio petto, che tiene in funzione il suo cuore, e non vi sono elementi chimici conosciuti in grado di sostituirlo. Grazie però all'aiuto del padre Howard e di Nick Fury, capo dello S.H.I.E.L.D., Tony Stark costruisce un acceleratore di particelle con il quale riesce a sintetizzare un nuovo elemento superpesante, in grado di alimentare il reattore al posto del palladio. Non c'è che dire: un supereroe è sempre un supereroe!

La struttura del nuclide superpesante sintetizzato da Tony Stark
Dobbiamo però rendere conto di una recente scoperta, avvenuta nell'estate 2023 alla Riken RI Beam Factory di Wako, in Giappone: la sintesi dell'ossigeno-28, un isotopo dell'ossigeno che ha 8 protoni e ben 20 neutroni nel suo nucleo. Gli scienziati avevano previsto che questo isotopo fosse insolitamente stabile, ma le prime osservazioni del nucleo di ossigeno-28 suggeriscono che esso si disintegri rapidamente subito dopo la creazione, e se ciò sarà confermato, potremmo essere costretti ad aggiornare le nostre teorie sulla struttura dei nuclei atomici. Per testare testando le teorie su come i nuclei atomici stanno insieme, un metodo classico consiste nel caricare i nuclei leggeri, come l'ossigeno, con un eccesso di neutroni e vedere che cosa succede. Come abbiamo visto sopra, i numeri magici dovrebbero valere 2, 8, 20, 28, 50, 82 e 126 . L'ossigeno-16 è doppio magico, grazie ai suoi otto protoni e otto neutroni. Dunque anche l'ossigeno-28, con otto protoni e 20 neutroni, dovrebbe essere doppio magico. Invece Takashi Nakamura, fisico del Tokyo Institute of Technology, ha affermato che l'isotopo non si è comportato affatto come se fosse doppio magico, disintegrandosi quasi subito. E questo non è il primo indizio del fatto che l'elenco dei numeri magici non è universalmente applicabile: già nel 2009 Rituparna Kanungo, docente di fisica alla Saint Mary's University di Halifax, in Canada, aveva dimostrato che, contrariamente a quanto ritenuto, l'ossigeno-24 ha un nucleo che si comporta come se fosse doppio magico: gli otto protoni e i 16 neutroni che lo compongono sono fortemente legati l'uno all'altro, il che gli conferisce un'emivita relativamente lunga: 61 millisecondi. Ciò significa che in alcuni nuclei, se sono fortemente legati, anche 16 potrebbe essere un numero magico. Conclusione: i numeri magici non sono immutabili, ma dipendono dalle circostanze. Ora Nakamura vuole verificare se sia possibile rilevare l'ossigeno-30: poiché la stabilità dei diversi isotopi è una misurazione relativa, sarebbe utile confrontare l'ossigeno-28 con questo vicino più pesante, ancora sconosciuto.
Prima di andare avanti, vorrei segnalare in breve un mistero che circonda la misura effettiva del raggio del protone. Il valore comunemente accettato per questo raggio è di 0,8768 Fermi (o femtometri, cioè 0,8768 x 10–15 metri), ed è stato ottenuto attraverso lo scattering elettronico, cioè mandando un fascio di elettroni a urtare contro l'idrogeno. Nel 2010 questo valore è stato confermato da Jan Bernauer utilizzando l'acceleratore MAMI a Magonza. Tuttavia nello stesso anno Randolf Pohl del Max-Planck-Institut für Quantenoptik di Garching (Germania) ha condotto un esperimento che utilizza la spettroscopia laser su atomi muonici, nei quali l'elettrone è stato sostituito con un suo parente più pesante e a vita breve, il muone appunto: ebbene, Pohl e collaboratori hanno trovato un valore più piccolo del 4 % rispetto alle attese. Per individuare eventuali errori, nel 2017 Pohl ha eseguito un altro esperimento alla Johannes Gutenberg Universität di Magonza, sollecitando atomi di idrogeno con due diversi laser: il primo ha spostato gli elettroni degli atomi in uno stato eccitato, e il secondo li ha portati a un'eccitazione ancora superiore. Il gruppo ha poi rilevato i fotoni rilasciati dagli atomi quando questi elettroni sono tornati a stati di eccitazione di bassa energia, ha calcolato con altissima precisione la costante di Rydberg, che esprime l'energia necessaria per strappare l'elettrone dall'atomo di idrogeno, e da questa ha ricavato il raggio del protone. Il risultato ottenuto però non ha fugato i dubbi; anzi, il raggio del protone stavolta è risultato più piccolo del 5 % rispetto a quello "ufficiale", rimpicciolendone ancor più le dimensioni. Ormai tra i fisici nucleari si parla apertamente di "mistero del raggio del protone", e sempre più esperimenti si concentrano su questa misura per riuscire a sbrogliare l'inghippo. Fino ad oggi, però, il mistero resta fitto, confermando che c'è ancora da scoprire molto più di quanto è già stato scoperto sinora.