

Uno dei primi grandi eventi che segnarono la scienza del Ventesimo Secolo fu la scoperta della radioattività naturale, compiuta nel 1896 dal fisico francese Henri Becquerel (1852-1902): mentre cercava di evidenziare la possibile emissione di raggi X da parte di alcuni metalli resi fluorescenti, scoprì quasi casualmente che i sali d'uranio contenuti in un cassetto avevano la proprietà di annerire delle lastre fotografiche, benché esse fossero accuratamente racchiuse entro involucri opachi alla luce. Naturalmente egli pensò che il fenomeno fosse connesso con la fluorescenza indotta dalle onde luminose, ma poi intuì che il fenomeno doveva essere ascritto alla presenza di alcune misteriose radiazioni, penetranti come i raggi X, emesse spontaneamente dall'uranio, senza bisogno di alcuna eccitazione preventiva. Becquerel ebbe anche l'intuizione che i raggi da lui scoperti e quelli trovato da Röntgen non avessero la stessa natura. Inoltre, egli suppose che tale radiazione non fosse emessa unicamente dai sali di uranio.

Henri Becquerel (15 dicembre 1852 – 25 agosto 1908)
Naturalmente lo scalpore suscitato dalla scoperta di Becquerel fu enorme, ed un gran numero di ricercatori cominciarono ad interessarsi egli strani effetti di quelle radiazioni. Tra questi c'era Maria Skłodowska (1867-1934), brillante studentessa polacca che, venuta a Parigi per motivi di studio, sposò il suo professore Pierre Curie (1859-1906), già noto per la scoperta della piezoelettricità, assumendo il nome di Marie Curie, e i due divennero i coniugi più famosi della storia della Fisica. Fu proprio Pierre a spingere Maria ad occuparsi delle radiazioni appena scoperte da Becquerel. Mediante un'analisi sistematica degli elementi allora noti, i due accertarono la radioattività del torio e dei suoi composti; avendo poi notato che l'emissione radioattiva era proporzionale alla quantità di uranio presente, e che gli effetti radioattivi erano indipendenti dallo stato chimico e dalle condizioni fisiche del materiale, i due cercarono di isolare i materiali radioattivi per studiarli meglio. Avendo poi notato che il minerale d'uranio chiamato pechblenda possiede una notevole radioattività, ne fecero arrivare alcune tonnellate dalla miniera boema di St. Joachimsol, e ne estrassero tutto l'uranio presente. Si accorsero però con sorpresa che il materiale residuo produceva molte più radiazioni di quanto doveva competere al tenore di uranio che vi era rimasto, e pensarono alla possibile esistenza di altre sostanze radioattive, ancora del tutto ignote. Dopo un lungo e faticoso lavoro, i due estrassero due nuovi elementi radioattivi, che chiamarono radio (per la sua notevole attività radioattiva) e polonio, in onore della lontana patria di Maria. Per queste scoperte, i coniugi Curie condivisero con Henri Becquerel il Premio Nobel per la Fisica del 1903 « in riconoscimento dei servizi straordinari che essi hanno reso nella loro ricerca sui fenomeni radioattivi ». Purtroppo il 19 aprile 1906 Pierre Curie morì finendo sotto le ruote di una carrozza mentre attraversava la strada, e Marie rimase sola, ma proseguì gli studi autonomamente, e dovette ricredersi chi dubitava delle sue capacità: a un giornalista, che le chiedeva come fosse vivere accanto a un genio, rispose: « Chiedete a mio marito! » Infatti nel 1911 le fu assegnato un secondo Nobel, stavolta per la Chimica « in riconoscimento dei suoi servizi all'avanzamento della chimica tramite la scoperta del radio e del polonio, dall'isolamento del radio metallico e dallo studio della natura e dei componenti di questo notevole elemento. » Marie Curie fu la prima donna ad essere ammessa ad insegnare alla Sorbona; la sua primogenita Irène e suo genero Frédéric Joliot vinsero anch'essi il Premio Nobel, stavolta per la scoperta della radioattività artificiale, nel 1935; l'altra figlia, Ève Curie, divenne biografa della madre e consigliere speciale del Segretariato delle Nazioni Unite. Marie Curie si spense in un sanatorio il 4 luglio 1934, a 66 anni, a causa di una leucemia, malattia che oggi sappiamo causata tra l'altro da un'eccessiva esposizione alle radiazioni ionizzanti. Pur disponendo di alcune conoscenze sulle conseguenze patologiche delle sostanze radioattive, quei pionieri delle ricerche nucleari, trascinati dall'entusiasmo, non si preoccuparono di prendere le dovute preoccupazioni prima di manipolare quelle pericolosissime sostanze.

Monumento a Pierre e Marie Curie davanti all'Institut Curie di Parigi
Fra i molti centri di ricerca che si occuparono attivamente dello studio dei fenomeni radioattivi ricordiamo il Cavendish Laboratory di Cambridge, dove Joseph John Thomson (1856-1940), già scopritore dell'elettrone e ideatore del primo modello atomico (« modello a plumcake »), compì accurate ricerche sul potere ionizzante delle radiazioni emesse dagli elementi radioattivi, e il neozelandese Ernest Rutherford (1871-1937), lo scopritore del nucleo atomico, fornì le prime indicazioni sulle proprietà dei raggi scoperti da Henri Becquerel.
Nel 1899 infatti Rutherford riconobbe che un elemento radioattivo emette due diverse specie di radiazioni, differenti per la carica e per il loro potere penetrante nella materia. Senza troppa fantasia, la componente positiva e meno penetrante fu chiamata raggi alfa (α), quella negativa e più penetrante ebbe il nome di raggi beta (β). Il fisico francese Paul Villard (1860-1934) nel 1900 scoprì un terzo tipo di radiazione, ancor più penetrante dei raggi beta e priva di carica elettrica, che logicamente battezzò raggi gamma (γ). Per fermare i raggi alfa, basta un foglio di carta; per fermare i raggi beta, occorre un centimetro di acciaio; i raggi gamma invece necessitano addirittura di un metro di calcestruzzo! Rutherford vinse nel 1908 il Premio Nobel per la Chimica per aver determinato la vera natura dei raggi alfa, i quali altro non sono che nuclei di elio (detti per questo anche elioni) carichi positivamente, con numero atomico Z = 2 e massa atomica A = 4. Infatti, lasciando in un contenitore di vetro una sostanza radioattiva che generava raggi alfa, egli scoprì che dopo molto tempo in esso compaiono tracce di gas elio, assente all'inizio dell'esperimento. Lo stesso Rutherford accertò poi che i raggi beta sono costituiti da elettroni, non però provenienti dall'atomo come i raggi catodici, ma dall'interno del nucleo, e per questo estremamente più energetici, cioè più penetranti. Mentre i raggi beta hanno uno spettro continuo, cioè energia variabile con continuità sino ad un massimo caratteristico dell'elemento preso in esame, i raggi alfa hanno solo alcune energie ben determinate, e perciò il loro è uno spettro a righe.
Inizialmente Rutherford pensava che i raggi gamma consistessero di particelle beta molto veloci, ma la scoperta della loro riflessione sulla superficie di un cristallo dimostrò che si trattava non di particelle ma di una radiazione elettromagnetica; Rutherford ed il suo collaboratore Edward Andrade (1887-1971) misurarono per primi la lunghezza d'onda dei raggi gamma emessi dal radio, scoprendo che essi hanno una lunghezza d'onda ancor più piccola dei raggi X, e quindi sono ancora più energetici. La fantascienza si impossessò subito di questi raggi misteriosi, facendone il prototipo di un'arma terrificante, ed infatti nella sigla italiana del Grande Mazinga si canta tra l'altro:
« Forte, con una mano spacca una montagna,
dagli occhi sputa fuori raggi gamma:
non c'è chi è forte più di te Mazinga, Robot... »
In realtà i raggi gamma non possiedono nei confronti della materia le capacità distruttive immaginate dai cartoni animati giapponesi (ad es. non possono far saltare per aria un altro robot), ma comunque restano pericolosissimi per i loro effetti sulla materia vivente. Naturalmente poi non sarebbe possibile "vedere" i raggi gamma scaturire dagli occhi del Grande Mazinga, giacché la loro frequenza è maggiore di 1020 Hz e la loro lunghezza d'onda è minore di 3 x 10−13 m (minore del diametro di un atomo), dunque largamente al di fuori del campo di visibilità non solo dell'uomo, ma di qualunque essere vivente terrestre. Inoltre Tetsuya Tsurugi, il pilota del Grande Mazinga, sarebbe il primo a morire allorché attiva i raggi gamma urlandone il nome, giacché il suo posto di guida è posto immediatamente sopra gli occhi del robot!
La radioattività non è un fenomeno atomico, bensì nucleare: le particelle α, β e γ provengono non dagli orbitali elettronici dell'atomo, ma dal suo nucleo. Oggi sappiamo che la radiazione γ è un prodotto secondario che accompagna l'emissione corpuscolare. In seguito all'emissione di particelle α e β, infatti, il nucleo si sposta in uno stato eccitato, e nel ritornare allo stato fondamentale emette una radiazione γ (proprio come, passando da uno stato eccitato a quello fondamentale, l'elettrone di un atomo emette un fotone di luce visibile). In ogni caso, ogni volta che esso emette una particella α o β, esso modifica la propria struttura, e dunque subisce una trasformazione detta comunemente decadimento radioattivo. Cambiando il numero di protoni, ciò implica che un elemento chimico si trasformi in un altro, cosa impossibile da realizzare mediante reazioni chimiche. È la realizzazione del sogno degli antichi alchimisti, che speravano di trasformare il piombo in oro per mezzo della pietra filosofale!
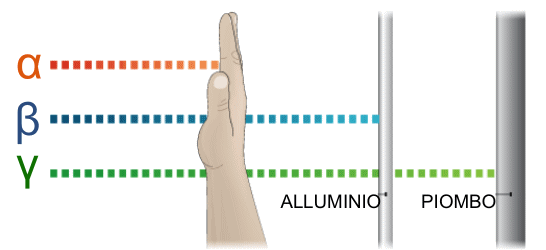
|
Questo schema illustra il potere di penetrazione delle radiazioni. I raggi beta, a differenza dei raggi alfa, sono in grado di attraversare il corpo umano, ma vengono schermati dai metalli leggeri. I raggi gamma hanno un elevato potere di penetrazione e sono schermati solo da metalli pesanti |
In base ad uno schema proposto da Rutherford e dal suo collaboratore Sir Frederick Soddy (1877-1956), la fenomenologia dei decadimenti radioattivi può essere compendiata nella cosiddetta legge dello spostamento. Sia un isotopo radioattivo di numero atomico Z e massa atomica A, che emette una particella alfa. Essendo un nucleo di elio formato da due protoni e due neutroni, il numero atomico si abbassa di due unità e la massa atomica di quattro unità, dato che il nucleo perde quattro nucleoni, di cui due protoni carichi positivamente:
![]()
Un esempio di decadimento alfa è quello subito dall'uranio:
![]()
Effettivamente il nucleo di elio costituisce quello che viene chiamato un "nucleo doppio magico", cioè una struttura di protoni e neutroni particolarmente stabile, esattamente come la struttura elettronica dei gas nobili; così stabile, da venire espulsa dal nucleo di partenza tutta intera, come se fosse un'unica particella.
Invece esistono due tipi di decadimento beta. Il primo è il decadimento beta meno, che lascia costante la massa atomica, mentre il numero atomico aumenta di un'unità, emettendo un elettrone beta e un antineutrino elettronico:
![]()
Un classico esempio è costituito dal carbonio-14, isotopo che come vedremo viene utilizzato per datare campioni archeologici, perchè la sua quantità dimezza esattamente in 5730 anni:
![]()
Esiste anche il decadimento beta più, che lascia inalterata la massa atomica, mentre il numero atomico diminuisce di un'unità, emettendo un positrone e un neutrino elettronico:
![]()
Il decadimento beta meno è particolarmente importante perchè, a partire dall'ultimo elemento conosciuto in natura, l'uranio, con Z = 92, può generare nuovi elementi, mai osservati prima nell'universo, con numero atomico maggiore di 92. Ad esempio, il decadimento β– dell'uranio genera un nuovo elemento, con Z = 93, scoperto nel 1940 al Radiation Laboratory dell'Università di Berkeley da Edwin McMillan (1907-1991) e Philip Hauge Abelson (1913-2004), che lo battezzarono nettunio perchè viene dopo l'uranio, così come il pianeta Nettuno viene dopo il pianeta Urano. Il decadimento β– del nettunio genera a sua volta il plutonio, con Z = 94 (il pianeta Plutone, oggi declassato a pianeta nano, viene dopo il pianeta Nettuno), sintetizzato nel 1940 da Edwin M. McMillan, Glenn Theodore Seaborg (1912-1999), Joseph William Kennedy (1916-1957) e Arthur Charles Wahl (1917-2006). Tali elementi vengono chiamati elementi artificiali.
Pochi sanno che, fino a pochi anni fa, le punte dei parafulmini erano realizzate con una sostanza radioattiva, affinché essa ionizzasse l'aria circostante, creando uno stato di plasma e dunque una via preferenziale al passaggio di corrente (perchè dotata di minore resistenza) rispetto all'aria circostante, aumentando la probabilità di scarica. Allo scopo si utilizzavano nuclei che emettevano particelle alfa, la cui emissione, contrariamente alle particelle beta e ai raggi gamma, era fortemente schermata dall'aria già a 20 centimetri di distanza dalla punta del parafulmine (di solito i nuclei utilizzati erano il bismuto-214 e il radio-226). Questa abitudine era però pericolosa per via dell'usura dovuta agli agenti atmosferici e del rischio di dispersione di polveri radioattive portate dall'aria anche a grandi distanze. Fortunatamente dal 2000 è diventato obbligatorio smantellare i parafulmini radioattivi precedentemente installati.
A questo punto, una domanda è d'obbligo. Perchè, in seguito ad un decadimento alfa, ogni nucleo si trasforma in un altro di numero atomico ( Z – 2 ) e massa atomica ( A – 4 ), mentre in seguito ad un decadimento beta meno si trasmuta in un nucleo con numero atomico ( Z + 1 ) e massa atomica invariata? Come interpretare questo fatto?