

Prima di presentare un modello nucleare in grado di rendere ragione della legge dello spostamento, forniamo qualche altra indicazione sul decadimento. In base ai principi della Meccanica Quantistica, il decadimento spontaneo di un nucleo è un avvenimento puramente casuale. Tuttavia, se è vero che risulta impossibile determinare l'istante in cui il nucleo di un atomo si disintegrerà è pur sempre possibile predire la probabilità che ha un certo numero di nuclei di disintegrarsi in un certo intervallo di tempo, esattamente come non si può predire quando un certo individuo morirà, ma si può stabilire la speranza matematica, cioè la probabilità, che egli ha di campare fino ad una certa età.
Come fare? Per risolvere questo problema dovremo far ricorso agli strumenti dell'Analisi Matematica. Sia N(t) il numero (molto grande) di nuclei radioattivi di un certo isotopo instabile. Dopo un breve intervallo di tempo Δt, un certo numero di quei nuclei è decaduto, e quindi sarà sopravvissuto di essi un numero N(t + Δt) < N(t). ne consegue che il numero di nuclei che si è disintegrato è pari a:
![]()
La cosiddetta attività del radioisotopo, cioè il numero di nuclei che si sono disintegrati nell'unità di tempo, è data naturalmente dal rapporto:
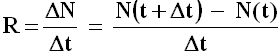
Se Δt tende a diventare piccolissimo, bisogna passare al limite, ed otterremo che l'attività di quell'isotopo radioattivo è pari al limite del rapporto ora scritto quanto Δt tende a zero. Ma questo rapporto è il rapporto incrementale di N(t), e il suo limite per Δt tendente a zero è la derivata di N rispetto al tempo:
Il segno meno è necessario perchè la variazione di N(t) nel tempo espresso dalla derivata è negativa. Infatti, al trascorrere del tempo, il numero N dei nuclei considerati diminuisce inesorabilmente. Ora, come il numero dei decessi che si registrano in una certa nazione è ovviamente proporzionale al numero di abitanti della città, così, qualunque sia la natura dell'isotopo, il numero di atomi che decadono è direttamente proporzionale al numero N di atomi inizialmente presenti all'istante t. In simboli:
dove λ è una costante di proporzionalità detta costante di disintegrazione, che ha come dimensioni fisiche l'inverso di un tempo. Confrontando tra loro la (1) e la (2) otteniamo un'equazione differenziale:
![]()
che si può scrivere, separando le variabili:

Integriamo ora entrambi i membri della precedente:
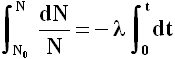
dove N0 è il numero di nuclei dell'isotopo all'istante t = 0. Si ottiene facilmente:
![]()
che, per le proprietà dei logaritmi, può essere riscritta nella forma:

e, tenendo conto del fatto che l'operazione inversa del logaritmo è l'esponenziale, si ha infine:
Questa viene chiamata legge del decadimento radioattivo. Essa ci dice che il numero di nuclei non ancora disintegratisi decresce esponenzialmente nel tempo. L'andamento di tale curva è il seguente:

Si dice emivita o tempo di dimezzamento di un isotopo radioattivo, e lo si indica con T1/2, l'intervallo di tempo dopo il quale il numero totale dei nuclei si è dimezzato, passando da N0 a N0/2. Ovviamente dopo un tempo pari a 2 T1/2 il numero dei nuclei scende a N0/4, dopo 3 T1/2 passa a N0/8, e in generale dopo k T1/2 si ha N(t) = T1/2/2k. In altre parole, se l'emivita di un isotopo radioattivo è pari a un minuto, considerando un campione di 1000 nuclei dopo un minuto saranno diventati 1000/2 = 500, dopo due minuti saranno diventati 1000/4 = 250, dopo tre minuti ne saranno rimasti 1000/8 = 125, e così via.
Ponendo N = N0/2 nella (3), si ottiene:
![]()
da cui si ricava, per le proprietà dei logaritmi:
Dunque l'emivita è legata alla costante di disintegrazione λ, ed entrambi tali parametri dipendono dall'isotopo considerato. L'inverso di λ invece prende il nome di vita media del nostro radioisotopo, e la si indica con la lettera greca τ. Essa è pari a:
Sostituendo tale valore nella (3) si ottiene:
![]()
In pratica, τ è il tempo necessario affinché il numero di nuclei dell'isotopo considerato si riduca ad una frazione pari ad 1/e = 36,8 % del valore iniziale. La tangente in t = 0 al grafico sopra tracciato intercetta l'asse dei tempi proprio nell'istante t = τ, il che permette di affermare che τ è il tempo nel quale l'isotopo decadrebbe completamente, se il suo decadimento fosse lineare e non esponenziale. In teoria il numero dei nuclei presi in considerazione si riduce a zero solo dopo un tempo infinito, ma in pratica dopo un tempo pari a 3τ il numero di nuclei superstiti si può considerare trascurabile. Di qui il nome di vita media.
Considerando alcuni isotopi tra i più pesanti, il bismuto-209 (Z = 83) ha un'emivita di ben 20 miliardi di miliardi di anni; l'uranio-238 (Z = 92) ne ha una di 4 miliardi e 470 milioni di anni; l'uranio-235 di 704 milioni di anni; il plutonio-239 (Z = 94) di 24.200 anni; il radio-226 (Z = 88) di 1622 anni; il californio-250 (Z = 98) di 13 anni; l'einsteinio-252 (Z = 99) di 471,7 giorni; il mendelevio-258 (Z = 101) di 51,5 giorni; il dubnio-268 (Z = 105) di 29 ore; il seaborgio-269 (Z = 106) di 2,1 minuti; il bohrio-270 (Z = 107) di 61 secondi; il röntgenio-282 (Z = 111) di 0,5 secondi; e il livermorio-292 (Z = 116) di soli 18 millisecondi. Questi dati ci dicono che, nell'unità di tempo, i nuclei di radio-226 hanno una probabilità di disintegrarsi di gran lunga inferiore di quella del dubnio-268, perché λ rappresenta la probabilità che un nucleo ha di decadere, anche se non si può escludere che qualche nucleo di dubnio "viva" più a lungo di qualche nucleo di radio. La vita effettiva di un nucleo radioattivo può variare tra zero ed infinito, dato che il decadimento è un evento puramente casuale. Se invece consideriamo un numero molto grande di nuclei di un isotopo radioattivo, ed applichiamo ad esso le leggi della Statistica, scopriamo che il valor medio delle durate delle vite dei singoli isotopi coincide proprio con la vita media definita dalla (5)!
L'attività R può essere misurata attraverso opportuni strumenti, il più semplice dei quali è il contatore Geiger, ideato nel 1913 da Hans Wilhelm Geiger (1882-1945). L'unità di misura dell'attività nel sistema internazionale è il Becquerel (simbolo Bq), così chiamato in onore dello scopritore della radioattività naturale, che equivale ad una disintegrazione al secondo. La prima unità di misura di questa grandezza, introdotta nel 1910, fu però il Curie (simbolo Ci), pari all'attività di un grammo del radio-226, materiale scoperto proprio dai coniugi Curie. Esso, decadendo alfa, cioè emettendo una particella α, si trasforma in radon-222, con un periodo di dimezzamento di circa 1622 anni. Ora, la λ del radio-226 misura:
λ = 0,693/T1/2 = 1,36 x 10–11 s–1
Ma in un grammo di radio-226 quanti nuclei sono presenti? La sua mole è pari a 226 grammi, e in una mole c'è un numero di Avogadro di nuclei, per cui:
N = ( 6,02 x 1023 nuclei/mol ) / ( 226 g/mol ) = 2,66 x 1021 nuclei/g
e quindi l'attività del radio vale:
R = N λ = 1,36 x 10–11 s–1 x 2,66 x 1021 nuclei/g = 3,7 x 1010 nuclei/g s
Se ne deduce che l'attività di un Curie corrisponde a 37 miliardi di decadimenti al secondo:
1 Ci = 3,7 x 1010 Bq
Si tratta, come si vede, di un'unità piuttosto grande, perchè il radio è particolarmente attivo. Per questo si usano sottomultipli come il milliCurie (mCi) e il microCurie (μCi).

Quadrante di orologio anni '50
verniciato con una
vernice radioluminescente contenente radio-226
.
Esempio 1: consideriamo un campione di plutonio-239. Di esso sappiamo già che T1/2 = 24.400 anni = 24.400 x 365 x 24 x 3.600 secondi = 7,69 x 1011 s. Applicando la (4) e la (5) se ne conclude che:
λ = 0,693/T1/2 = 9 x 10–13 s–1
τ = 1 / λ = 1 / 9 x 10–13 s–1 = 1,11 x 1012 s
Supponiamo di avere un grammo di plutonio-239. La mole di tale isotopo equivale a 239 grammi, e siccome una mole di sostanza contiene un numero di Avogadro dei suoi atomi, un grammo ne conterrà:
N = 6,022 × 1023 / 239 = 2,52 x 1021
Per la (2) la sua attività sarà pari a:
R = λ N = 9 x 10–13 x 2,52 x 1021 = 2,27 x 109 Bq = 0,06 Ci
.
Esempio 2: Sia un isotopo radioattivo che, posto vicino a un contatore Geiger, segnala 400 disintegrazioni al minuto; dopo 8 giorni, la stessa misura fornisce 165 disintegrazioni al minuto. Quanto valgono il periodo di dimezzamento e la costante di disintegrazione di quell'isotopo?
Detto N0 il numero di nuclei oggi e N1 il numero dei nuclei tra 8 giorni, dalla (3) si ricava la formula inversa:

Sostituendo nella precedente si ha:
λ = – ln (165/400) / ( 8 x 24 x 3600 s ) = 1,281 x 10–6 s–1
da cui:
T1/2 = 0,693/λ = 5,41 x 106 s = 6 giorni 6 ore 15 minuti 27 secondi
.
Esempio 3: Oggi la miscela naturale di uranio è formata dallo 0,72 % di uranio-235 e dal 99,28 % di uranio-238 (più tracce di uranio-234). Ma i due isotopi sono radioattivi ed hanno tempi di dimezzamento rispettivamente di 703,8 milioni di anni e di 4,468 miliardi di anni. Questa differenza tra le due emivite fa sì che il rapporto tra i due isotopi cambi nel tempo. Quale era la percentuale dei due isotopi due miliardi di anni fa?
Si considerino 10.000 nuclei di uranio. Oggi, di essi 72 sono di uranio-235 e 9.928 sono di uranio-238. Calcoliamo anzitutto i valori di λ dei due isotopi:
λ (235U) = 0,693/T1/2 (235U) = 9,85 x 10–10 anni–1
λ (238U) = 0,693/T1/2 (238U) = 1,55 x 10–10 anni–1
Usando la formula inversa della (3), si ricava la quantità di nuclei di uranio-235 che hanno dato vita, dopo due miliardi di anni, ai 72 nuclei oggi rimasti:
N0,235 = N(oggi) / e–λt = 72 / e–1,97 = 516
Analogamente si trova la quantità di nuclei di uranio-238 che hanno dato vita, dopo due miliardi di anni, ai 9.928 nuclei oggi rimasti:
N0,238 = N(oggi) / e–λt = 9.928 / e–0,31 = 13.536
Quindi in totale si trattava di 516 + 13.536 = 14.052. Siccome 516 / 14.052 = 0,037, se ne conclude che due miliardi di anni fa la percentuale isotopica era del 3,7 % di uranio-235 e del 96,3 % di uranio-238. Questo risultato ci sarà molto utile nella lezione sui reattori nucleari, parlando del reattore naturale di Oklo.