![]()
cliccate sulle immagini per ingrandirle
![]()
cliccate sulle immagini per ingrandirle

|
Questa foto mostra un'esperienza assai semplice da eseguirsi all'inizio dello studio della termodinamica: la taratura del termometro. Lo stesso strumento viene immerso prima in acqua con ghiaccio tritato, poi in acqua bollente (il ghiaccio è prelevato da un frigorifero in laboratorio di chimica, l'acqua è fatta bollire in un becker mediante fornelletto a spirito e reticella). Come si vede da questa foto, il termometro è retto da un apposito supporto metallico per impedirgli di toccare le pareti di vetro. |

|
Qui invece il termometro è semplicemente infilato dentro il becker pieno di acqua e ghiaccio fondente. In questo modo gli studenti possono rendersi conto di come due soste termiche dovute al cambiamento di stato (ghiaccio-acqua ed acqua-vapore) vennero utilizzate da Anders Celsius per individuare 0° C e 100° C della scala centigrada. Utilizzando un cronometro è addirittura possibile costruire il diagramma tempo-temperatura e visualizzare le due soste termiche! |

|
Altra esperienza elementare e di sicuro successo: l'anello di Gravesande. Lo strumento è costituito da una sfera di acciaio pendente da un gancio attraverso un anello appena più grande del suo diametro (in fotografia, l'anello è spostato verso sinistra mediante una vite di regolazione). Come si vede, la sferetta è arroventata tramite un fornelletto ad alcool. Dopo essere stata riscaldata, come si vede sulla destra, essa non passa più dall'anello: evidente dimostrazione del fenomeno della dilatazione cubica. Questo strumento è detto anche dilatoscopio perchè permette solo una verifica qualitativa del fenomeno. |

|
Una misura quantitativa della dilatazione termica è possibile mediante questo strumento davvero suggestivo, detto dilatometro. Esso consiste in un lungo fornelletto che arroventa una sbarretta di metallo intercambiabile; quando questa si allunga in seguito al fenomeno della dilatazione termica, muove una lancetta lungo una scala graduata, che permette di misurare l'allungamento con estrema precisione. |

|
Quest'altra foto illustra il dilatometro in azione. Il tecnico di laboratorio ha impregnato di alcool il fornelletto sottostante, poi lo ha acceso, arroventando la sbarra di rame che si può allungare solo verso sinistra, essendo bloccata a destra da una vite. In questa foto si vede benissimo il sistema di leve in grado di amplificare l'effetto dell'allungamento e di far muovere la lancetta del dilatometro lungo la scala graduata. Il successo è garantito. Cliccando qui potete scaricare anche una foto ancora più suggestiva di quest'esperimento, scattata dalla studentessa Veronica Tomasini. |

|
Sul principio della dilatazione termica dei corpi solidi è basato anche questo termometro metallico. Esso è costituito da due archi metallici collegati ad una lancetta che, come si vede, è libera di scorrere su di una scala graduata. Riscaldando il tutto i due archi si dilatano e la lancetta si sposta dallo zero; raffreddando il tutto, gli archi si contraggono e la lancetta si muove nella direzione opposta. |

|
L'apparecchio di Tyndall qui fotografato serve per dimostrare l'intensità della forza di trazione esercitata da un tubo di ferro che, raffreddandosi, si contrae: essa è sufficiente per spezzare una barretta di ghisa! Basta riscaldare fortemente la sbarra di ferro a sezione quadrata, senza però arroventarla, e porla nelle incassature apposite della base, che portano sul fondo due cuscinetti di eternit, per impedire la rapida trasmissione del calore. Nell'occhiello della sbarra si introduce l'asta di ghisa, si applica il dado e si stringe fortemente. Ben presto l'asta si spezza sotto l'azione di una forza di oltre 5000 N! |

|
Questo ponte (ritratto nella metà superiore dell'immagine) ha una caratteristica curiosa: come si vede in basso, è separato dalle due rive del fiume da altrettante fessure. Questa soluzione serve naturalmente per compensare le dilatazioni e i restringimenti termici del ponte, che ne indebolirebbero irrimediabilmente la struttura! |

|
Lo strumento qui ritratto è chiamato in gergo cassetta di Ingenhousz (si pronuncia "Ingen-gòus"), dal nome del suo inventore, l'olandese Jan Ingenhousz (1730–1799). Si tratta in effetti di una cassetta a forma di parallelepipedo, aperta verso l'alto per potervi versare acqua calda. Sulla faccia anteriore sono applicate delle sbarrette di materiale differente ma della stessa sezione (ferro, rame, zinco, piombo...), tute ricoperte da uno strato di cera d'api. La quantità di cera fusa e colata da ogni sbarretta dipende dalla conducibilità termica del materiale di cui è composta, il che permette di dimostrare che i vari materiali conducono il calore in maniera differente. |

|
Altro pezzo storico del laboratorio Virtuale: l'apparecchio di Hope, usato per dimostrare che l'acqua a 4° C è più densa del ghiaccio, manifestando così una dilatazione termica "anomala". Esso è costituito da un cilindro dotato di un manicotto, sopra e sotto il quale sono introdotti due termometri, che segnano la stessa temperatura quando il cilindro è stato riempito d'acqua. Nel manicotto si immette un miscuglio frigorifero di ghiaccio e sale; l'acqua che si va raffreddando si porta in basso, e subito si nota l'abbassarsi del termometro inferiore, mentre quello superiore rimane quasi stazionario. L'abbassamento continua finché la temperatura inferiore avrà raggiunto + 4° C. Da questo momento in poi il termometro superiore discende rapidamente, avvicinandosi a zero, mentre l'altro resterà sui 4°, perché l'acqua a questa temperatura raggiunge il massimo peso specifico, e quindi non può essere sostituita da altra a più bassa temperatura. |

|
Un pezzo piuttosto raro: un termoscopio doppio di Looser. È costituito da due manometri riempiti di un liquido colorato. I rami più lunghi del manometro sono diretti parallelamente verso l'alto e poggiano su una scala graduata in millimetri, mentre i rami più corti terminano in vasi muniti ciascuno di un rubinetto e di una giunzione gommata, che collega gli stessi tramite dei tubi a delle capsule ad aria. Queste rappresentano gli elementi sensibili dello strumento. Esso permette di eseguire esperienze di dilatazione dei corpi, conduzione del calore, calore nei passaggi di stato e nelle reazioni chimiche, ecc... |

|
Lo strumento in questione è una bottiglia di Woulff, vale a dire una bottiglia di vetro a pareti spesse con un collo ripiegato due volte ad angolo retto. Può essere utilizzata come bottiglia di generazione dei gas, come contenitore di assorbimento o come bottiglia addizionale per prove che necessitano il controllo simultaneo della pressione. |

|
Per eseguire esperienze di termodinamica (ma anche di chimica) si può usare il fornelletto ad alcool oppure il becco Bunsen, come gli esemplari qui ritratti. Questi ultimi sono svantaggiati perché funzionano a gas, mentre per il fornelletto basta comune alcool, tuttavia il vantaggio consiste nel fatto che la fiamma è regolabile. |

|
Nuova foto scattata da Emanuele Ferrara (si vedono, anche se con il volto criptato, alcuni suoi compagni di classe della III B cl. a.s. 2005/06), che illustra l'esperienza dell'ebollizione sotto vuoto. Aspirando l'aria da sotto la campana di vetro, si vede l'acqua cominciare a bollire a temperatura ambiente, il che dimostra che la temperatura di ebollizione dipende dalla tensione di vapore, e quindi dalla pressione esterna! |

|
Altra foto, stavolta ripresa dal sottoscritto, dell'esperimento di ebollizione sotto vuoto da noi condotto in laboratorio di Fisica. Aspirando l'aria da sotto la campana, l'acqua contenuta nel becker si mette a bollire a temperatura ambiente perchè la pressione di vapore supera la pressione atmosferica sotto la campana. Di quest'esperienza è possibile scaricare anche un brevissimo ma significativo filmato digitale (il rumore di sottofondo è quello della pompa a vuoto).. |

|
Un'applicazione molto comune della dipendenza della temperatura dalla pressione esterna è la pentola di Papin o pentola a pressione. Facendo bollire l'acqua in un ambiente chiuso (la valvola si apre solo oltre un certo valore di pressione ed evita che la pentola scoppi), la pressione cresce e la temperatura di ebollizione si alza, e con essa il tempo necessario per raggiungerla, e quindi il tempo di cottura dei cibi. per questo Denis Papin (1647-1712), quando inventò questa pentola, la chiamò digestore perchè faceva cuocere meglio i cibi e li rendeva più digeribili! |

|
Cosa c'entra la moka in questo Armadio Virtuale? C'entra eccome, perchè la preparazione della nostra bevanda nazionale è tutta una questione di Termodinamica! Nella caffettiera infatti il calore del fornello scalda sia l'acqua del serbatoio, sia il sottile strato di aria che la sovrasta. La pressione di quest'ultima perciò aumenta, ed essa tende ad espandersi, comprimendo l'acqua del serbatoio. Quest'ultima come unico sfogo ha il beccuccio del filtro: di conseguenza sale e fluisce ad alta pressione attraverso la polvere di caffé, trasformandosi nella bevanda a tutti familiare. Infine, sempre spinto dalla pressione dell'aria calda, il liquido giunge nella sezione superiore della caffettiera; quando vi è ormai poca acqua nel serbatoio inferiore, essa arriva nel contenitore superiore mista ad aria calda, originando il tipico borbottio della caffettiera "pronta"! |

|
Continua la galleria delle foto scattate dal sottoscritto durante esperienze di termodinamica in laboratorio. Ecco un'altra semplicissima esperienza da eseguirsi con la macchina pneumatica (la si intravede a sinistra) e la campana di vetro (a destra). Sotto di essa è stato posto un becker contenente della comunissima schiuma da barba, reperibile praticamente dovunque. Dopo essersi assicurati che la campana aderisca perfettamente al basamento, che a questo scopo è stato unto di grasso per impedire l'uscita dell'aria, con la macchina pneumatica si aspira quest'ultima e... |

|
...ed ecco ciò che succede. La schiuma da barba aumenta di volume in maniera impressionante, per poi ritornare al volume consueto "sgonfiandosi" quando si fa riaffluire l'aria. Si tratta di un'evidente dimostrazione della legge di Boyle: il volume di un gas è inversamente proporzionale alla sua pressione. In questo caso il gas è rappresentato dalle bollicine d'aria intrappolate dentro la schiuma da barba, che si dilatano non appena la pressione esterna scende! Di questo esperimento, dal grandissimo impatto sugli studenti, è disponibile anche un breve filmato digitale. |

|
La stessa esperienza può essere eseguita in altra maniera, non meno spettacolare, usando un comune palloncino di gomma. Per rendere il risultato più spettacolare, nell'esperimento fotografato qui a sinistra si è usato un comune guanto di gomma da laboratorio leggermente gonfiato e annodato. Anche in questo caso si aspira l'aria da sotto la campana e... |

|
...ed il palloncino si gonfia in maniera abnorme. Si tratta di una nuova, efficace (per quanto qualitativa) dimostrazione della legge di Boyle: appena la pressione esterna cala, il volume di gas aumenta. Ciò avviene perchè i gas, a differenza dei solidi e dei liquidi, sono privi di volume proprio, e le molecole possono allontanarsi tra di loro a piacimento. Spettacoloso, eh? Anche di quest'articolo potete scaricare un voluminoso ma divertente filmato digitale. |

|
Quello in figura è uno strumento utile per una verifica qualitativa della legge di Gay-Lussac: si tratta di un cilindro di plexiglas dotato di stantuffo, che può essere abbassato a mano grazie al pomello nero in alto. Si svita il tappo del cilindro, si pone sul suo fondo un pezzetto di carta, vi si infila lo stantuffo e lo si preme con energia verso il basso. il volume diminuisce bruscamente, per la legge di Boyle la pressione cresce altrettanto bruscamente, e per la legge di Gay-Lussac la temperatura dell'aria in esso contenuta sale di colpo, arrivando ad incendiare il pezzetto di carta! Una dimostrazione davvero suggestiva delle fondamentali leggi dei gas. |

|
Una verifica quantitativa della legge di Boyle è invece eseguibile mediante questo semplice strumento, costituito (vedi foto a sinistra) da una siringa chiusa da un tappo ermetico, sul cui stantuffo è montata una piccola piattaforma di legno. Come si vede a destra, poggiando un peso da 5 Kg sullo stantuffo il volume diminuisce; ponendo due pesi da 5 Kg la variazione di volume risulta doppia; e così voi. La variazione di volume può essere riscontrata anche ponendo un numero crescente di libri (es. di fisica) tutti uguali fra di loro, e verificando l'inversa proporzionalità tra variazione di pressione e variazione di pressione! Semplice, no? |

|
Un'altra verifica quantitativa della legge di Boyle è possibile mediante questo strumento dotato di manometro, il quale dimostra che, all'aumentare della pressione, aumenta anche il volume occupato dall'aria, come dimostra la pallina d'acciaio che, man mano che la pressione sale, si sposta verso destra. Semplice ma efficace. |

|
L'oggetto in questione rappresenta un ingegnoso meccanismo per spiegare ai ragazzi il modello cinetico dei gas: un cuscino d'aria fa muovere dei bottoni di plastica che simulano le molecole, e modellizza un insieme di particelle di dimensioni trascurabili che interagiscono senza attrito solo per urti elastici. |

|
Ecco un altro ingegnoso congegno per simulare l'agitazione termica delle olecole di un gas in funzione della temperatura. Nel cilindro verticale di plexiglas sono contenute delle minuscole sferette, poste in agitazione da un pistone collegato ad un vibratore, a sua volta messo in funzione da un motorino elettrico la cui velocità è regolabile. Gli urti tra le sferette descrivono bene il modello cinetico dei gas, valido solo per un gas perfetto, cioè per un gas rarefatto e assai lontano dalla temperatura di liquefazione (in tal modo le molecole hanno tanta energia da interagire praticamente solo per urti elastici). |
 |
Quello a fianco è un modellino in cartone realizzato dall'autore di questo sito per illustrare l'esperienza di Stein, realizzata nel 1926 dal fisico tedesco Otto Stern (1888-1969). In pratica, si tratta di un selettore di velocità: due dischi uguali sono calettati sullo stesso albero, entrambi con una fessura radiale, ma montati in modo che le due fessure siano sfasate di un angolo α. Un forno genera un fascio di atomi di mercurio, indirizzato sui due dischi in rotazione con velocità angolare ω; le molecole che riescono a passare attraverso la fessura del primo disco vengono intercettate dal secondo, a meno che esse non abbiano velocità tale da percorrere la distanza l tra i due dischi nello stesso tempo in cui i dischi ruotano di un angolo pari ad α, così da "infilarle" una dopo l'altra. Variando la velocità ω, varia la velocità v delle molecole che "sopravvivono" al passaggio attraverso i due dischi; in questo modo, Stern poté verificare che gli atomi di mercurio gassoso obbediscono perfettamente alla distribuzione di Maxwell! |
|
|
L'immagine che vedete è stata ripresa nel salotto di casa mia il giorno di Capodanno 2006, ed illustra uno splendido esemplare di termometro galileiano che si trova in mio possesso. Sembra che lo strumento sia stato ideato da Galileo Galilei, ed è una applicazione del principio di Archimede. Dentro il tubo pieno d'acqua ci sono delle ampolline a loro volta piene di liquidi con varia densità; al variare della temperatura cambia la densità dell'acqua, e le ampolline affondano quando fa caldo, tornano a galla quando la temperatura risale. Ogni ampollina reca una medaglietta con una temperatura diversa; l'ultima tra quelle emerse fornisce la temperatura della stanza. Geniale! |

|
Quello dell'illustrazione precedente non è l'unico strumento di misura qualitativa che ho in casa. Quest'altra foto digitale, ripresa dal sottoscritto assieme alla precedente, mostra infatti un modello di igrometro artigianale, prodotto sulle Isole Borromee del lago Maggiore e regalatomi da un'amica. Si tratta di una statuetta dipinta con una vernice particolare: se l'umidità è scarsa, essa esibisce una colorazione azzurra, ma se l'ambiente è molto umido, diventa repentinamente di un rosa intenso. Tutto dipende dalle proprietà chimiche della vernice. Artigianato... scientifico! |

|
Quello dell'immagine precedente è uno strumento per così dire "giocattolo", ma questo è un vero e proprio igrometro. Esso funziona in base al principio del cosiddetto "igrometro a capello": un capello è sospeso ad una massa e gira sopra una ruota collegata alla lancetta. Al variare dell'umidità nella stanza, varia la lunghezza del capello, e la lancetta ruota sull'indice. Si noti che la lancetta indica umidità diverse a seconda della temperatura; è per questo che all'igrometro in questo caso è associato un normalissimo termometro a mercurio. |
 |
Ed ecco le spettacolari fotografie di un disco diamantato, costituito da un'anima di acciaio e da una corona diamantata perimetrale. L’anima di acciaio ad alta resistenza sostiene e porta in rotazione la parte diamantata per il taglio del marmo e di altri materiali per l'edilizia. Il taglio viene normalmente effettuato per successive "passate" sempre più profonde; la macchina che si vede in fotografia appartiene al signor Amerigo Cocozza, che mi ha cortesemente permesso di fotografarla per questa galleria. Faccio notare che, durante il taglio, il disco è bagnato con getti d'acqua, altrimenti l'attrito fortissimo manderebbe il tutto a fuoco. Possiamo così assistere in diretta alla trasformazione di energia meccanica in energia termica, cioè calore! |

|
Questa fotografia mi è stata inviata dalla gentile collega Elena Ricci, che ringrazio sentitamente, e raffigura un'esperienza molto semplice ed intuitiva per misurare il contenuto in calorie di un frammento di cibo infiammabile, in questo caso una patatina (ma anche una nocciolina americana, una caramella, ecc.). In assenza di un calorimetro si accende il frammento di cibo sotto un becker pieno di una quantità nota di acqua, e con un termometro se ne misura l'aumento di temperatura. L'esperienza è facile ed intuitiva, ma purtroppo non sempre precisa perchè non tutto il calore della combustione viene assorbito dall'acqua. I ragazzi tuttavia arrivano a comprendere che anche nel nostro corpo avviene una "combustione" del cibo. |

|
Per determinare l'equivalente meccanico della caloria, cioè il valore in Joule di una caloria, è possibile utilizzare un dispositivo chiamato calorimetro di Callender, visibile nel dettaglio in alto a destra. Si tratta in pratica di un cilindro di metallo le cui basi sono termicamente isolate, da fissare in un opportuno supporto (dettaglio a sinistra). Il tecnico di laboratorio avvolge attorno al calorimetro una fune da un lato vincolata ad una molla e dall'altro a un peso da 5 Kg. |

|
Questa foto, cortesemente scattata come la precedente e la seguente dall'allievo Roberto Carettoni (III B cl. 2005/2006), illustra il calorimetro di Callender montato in modo da poter iniziare l'esperimento; esso è stato riempito con 45 cc di acqua e poi tappato con un tappo di gomma in cui passa un termometro. A questo punto l'allievo impugna la manovella su cui il calorimetro è avvitato ed inizia a ruotarla con energia nella direzione che farebbe salire il peso da 5 Kg... |

|
Durante la rotazione il peso non deve sollevarsi più di pochi cm da terra, la manovella deve girare con velocità pressoché costante, e bisogna contare con precisione il numero di giri effettuati, che non deve essere inferiore a cento. Al termine, si legge con cura la temperatura ora segnata dal termometro, e confrontandola con quella registrata all'inizio dell'esperimento si rileva un incremento sensibile, dovuto all'attrito radente con il quale la fune strisciava contro la cassa del calorimetro. Il lavoro di rotazione si è interamente trasformato in calore, ed è così facile ricavare l'equivalente meccanico della caloria. Se volete, potete scaricare da qui un filmatino di circa 30 secondi che illustra quest'esperienza. |

|
Questa fotografia è stata scattata da Emanuele Ferrara (III B cl. a.s. 2005/06) ed illustra il necessario per eseguire la taratura di un calorimetro (lo strumento rosso visibile a sinistra). Si fa scaldare una quantità determinata di acqua fino a 60° C, si mette un'altra quantità determinata d'acqua dentro il calorimetro, se ne registra la temperatura, quindi si versa l'acqua calda nel calorimetro, lo si tappa velocemente e si registra la temperatura finale. Con un'equazione di bilancio termico è facile ricavare l'equivalente in acqua del calorimetro (la quantità d'acqua che ha la sua stessa capacità termica). |

|
La mano del sottoscritto ha sollevato il coperchio del calorimetro per mostrare il suo interno, a pareti riflettenti onde trattenere all'interno la maggior parte del calore; la parete è a doppio strato e fra di esse è praticato il vuoto per ridurre ancor più la dispersione termica. Il coperchio contiene il termometro a mercurio, necessario per misurare le variazioni di temperatura che avvengono all'interno in seguito al miscelamento di sostanze diverse, ed un agitatore a mano, utile per ottenere una distribuzione di temperatura che sia la più uniforme possibile. |

|
In questa foto, scattata da Roberto Carettoni e Chiara Rivolta (III B cl. 2005/06), sono visibili i solidi (in questo caso di alluminio, la cui massa è pari a 98,50 g) utilizzati per la misura del calore specifico utilizzando un apparato sperimentale del tutto analogo a quello della foto che precede. In questo caso i solidi vengono scaldati a bagnomaria fino a circa 98° C. |

|
Prosegue l'esperienza di termodinamica sopra descritta (la foto è degli stessi autori della precedente): come detto, i solidi di alluminio vengono scaldati a bagnomaria fino alla temperatura di ebollizione, prima di essere spostati rapidamente nel calorimetro. Si noti che la corda che li lega penzola all'esterno per poter spostare i solidi senza scottarsi le dita! Per vedere una originalissima relazione... a fumetti di questa esperienza, cliccate qui! |

|
Questa fotografia ci mostra l'apparato sperimentale per determinare la curva di temperatura di un liquido, in questo caso una soluzione di acqua e sale, presente nel becker a sinistra. La si scalda mediante un apposito fornelletto ad alcool, e si osserva che la temperatura di ebollizione supera i 100° C a causa della presenza del sale (nel becker ci sono anche frammenti di porcellana per rendere più uniforme la temperatura); è poi possibile osservare la sosta termica durante la transizione di fase. |

|
L'apparato sperimentale in figura serve invece per costruire la curva di temperatura di un solido, e precisamente dell'acido stearico (CH3(CH2)16COOH). In pratica, si riscalda il composto a bagnomaria e si vuole costruire un diagramma che ha in ascisse il tempo trascorso (misurato per mezzo di un cronometro) ed in ordinate la temperatura rilevata con un comune termometro. Lo scopo è quello di osservare la sosta termica, cioè il fenomeno per cui la temperatura resta costante durante la transizione di fase (il calore fornito serve a rompere i legami molecolari anziché ad aumentare la temperatura). |

|
Il collage di foto qui accanto mostra chiaramente il passaggio di stato dell'acido stearico. Nella prima fotografia a sinistra lo si vede ancora interamente solido, di un bianco latteo proprio come la cera delle cosiddette candele steariche. Nella seconda si vede in corso il passaggio di stato, mentre nella terza la sostanza si è completamente sciolta (il punto di fusione è di circa 58° C); nella quarta, dopo che la provetta è stata immersa in un becker di acqua tiepida, si osserva la rapida solidificazione dello stesso. Un'esperienza davvero semplice, che permette di far osservare agli studenti il fenomeno del passaggio di stato. |

|
Il ciclo dell'acqua è sicuramente il fenomeno più importante che permette l'esistenza della vita sulla Terra: l'acqua dei mari, dei fiumi, ecc. passa allo stato vapore sotto l'effetto dell'irraggiamento solare, per poi tornare a piovere sulla Terra in forma liquida. Ognuno di noi può constatare questo fenomeno nella cucina di casa sua: sopra questa pentola di brodo caldo è stato posto un coperchio trasparente e, man mano che il brodo si raffredda, sul coperchio si condensano grosse gocce d'acqua! |

|
Parlando di passaggi di stato, non si può non citare il fenomeno della nebbia. Si tratta a tutti gli effetti di una nube al livello del suolo, prodotta dalla repentina condensazione del vapore acqueo atmosferico negli strati immediatamente vicini al suolo, che si osserva nelle mattine invernali. Come scrive il Carducci: « La nebbia agl'irti colli / piovigginando sale... » |

|
Ed ecco invece il fenomeno della rugiada: in una mattina di primavera il vapore acqueo dell'atmosfera si è condensato sugli steli d'erba di un prato, passando dallo stato vapore allo stato liquido. Si dice "punto di rugiada" lo stato termico (caratterizzato da un preciso valore di pressione e temperatura) in cui l'aria di un ambiente diventa satura di vapor d'acqua; per concentrazioni maggiori di vapore si ha per l'appunto la formazione di gocce di rugiada. Nel I canto del Purgatorio, Virgilio adopera proprio la rugiada del Purgatorio per tergere dal volto di Dante la caligine dell'inferno. |

|
Si dice sublimazione il passaggio di stato direttamente da solido a vapore, e brinamento il passaggio inverso, da vapore a solido. Questa foto di un prato, scattata in una freddissima mattina invernale, mostra come il vapore acqueo dell'atmosfera si è in parte solidificato a contatto con gli steli d'erba, producendo il fenomeno della brina. Appena spunta il sole, la brina sublima nuovamente ritornando direttamente allo stato di vapore atmosferico. |

|
Il 16 gennaio 2012 un'eccezionale brinata ha trasformato la brughiera di Lonate Pozzolo in un'incredibile paesaggio innevato... senza neve. Si tratta di un esempio di galaverna, un deposito di ghiaccio sotto forma di aghi o di scaglie, tanto spesso da trasformarsi in un vero e proprio strato di ghiaccio. Queste eccezionali foto della brughiera intorno a Lonate Pozzolo le dobbiamo al signor Giuseppe Carraro del comitato Viva Via Gaggio. |

|
Un altro esempio di brinamento è chiaramente raffigurato qui a sinistra: in un vecchio frigorifero la guarnizione di chiusura della porta si è ormai usurata, cosicché il vapore acqueo dell'atmosfera filtra tranquillamente all'interno di esso e ghiaccia all'interno della cella frigorifera, che risulta così ricoperta di uno spesso strato di ghiaccio, proveniente direttamente dall'atmosfera. Questo è il motivo per cui i frigoriferi più vecchi vanno sbrinati molto più spesso di quelli nuovi. |

|
Ora assisteremo al fenomeno della sublimazione del ghiaccio secco. Il ghiaccio secco è l'anidride carbonica (CO2) allo stato solido, stato che viene raggiunto sotto i – 78 °C: la definizione di "secco" è dovuta proprio al fatto che in condizioni di pressione standard l'anidride carbonica passa dallo stato solido a quello gassoso senza passare per lo stato liquido. Come si vede, qui viene versato dalla collega Maria Rola in un apposito contenitore, usando i guanti perchè è così freddo che può provocare ustioni davvero serie! |

|
Quella che si vede qui ritratta è per la sublimazione del ghiaccio secco. Il solido biancastro visibile nel becker a sinistra passa immediatamente allo stato gassoso appena in esso si versa acqua, a temperatura considerevolmente più alta; quest'effetto speciale è spesso utilizzato al cinema per simulare l'acqua bollente. Una curiosità: spargendo alcuni piccoli cristalli di ghiaccio secco su un tavolo liscio, essi "corrono" sulla sua superficie come se neppure la toccassero, in totale assenza di attrito. Questo accade perchè il tavolo si trova ad una temperatura assai maggiore della CO2 solida, a contatto con esso sublima e forma una sorta di cuscino di gas che riduce l'attrito praticamente a zero! |

|
L'insolita fotografia, scattata il 3/01/2008 sullo scivolo di casa mia in corrispondenza di una breve nevicata, mostra l'effetto che ha il sale sparso sul ghiaccio. Infatti una miscela acqua + sale congela a una temperatura molto più bassa dell'acqua pura; perciò, spargendo del sale sul ghiaccio, esso si scioglie molto più rapidamente. A sinistra si vedono due foto del mio scivolo riprese ad alcune ore di distanza: sopra il ghiaccio è stato appena sparso, sotto si vede lo scivolo quasi completamente sgelato. Nell'ingrandimento sulla destra si vedono chiaramente i cristalli di sale circondati da chiazze di ghiaccio sciolto! |

|
Ed ecco il risultato di un facilissimo esperimento che tutti voi potete ripetere in casa vostra. Ho preso un normale tubetto in plastica per mentine, l'ho riempito d'acqua fino all'orlo, l'ho tappato (a sinistra) e poi l'ho messo nel freezer. Il mattino dopo il tubetto era... aperto (a destra). Come si vede chiaramente in figura, l'acqua, congelando, è aumentata di volume, spingendo il tappo in fuori. Ciò avviene perchè le molecole d'acqua, formando un cristallo di ghiaccio, lasciano degli spazi vuoti che aumentano il volume complessivo del solido. Così l'acqua, congelando nelle fessure delle rocce, finisce per sgretolarle! |

|
Il bollitore di Franklin è costituito da due bulbi in vetro raccordati tra loro, all'interno dei quali si trova dell'alcool colorato. L'aria è stata eliminata mediante l'ebollizione del liquido prima di effettuare la saldatura, per modo che il liquido non sopporta altra pressione che quella del suo vapore, molto piccola alla temperatura ambiente. Impugnando uno dei bulbi... |

|
...il calore fornito dalla mano dà al vapore una tensione sufficiente per mettersi a bollire tumultuosamente. Lo vediamo in quest'altro modello di bollitore di Franklin, nel quale i liquido è così volatile da porsi immediatamente in ebollizione appena si stringe la mano intorno al recipiente sottostante. Come conseguenza, il fluido sale rapidamente nel recipientente sovrastante. Per travasare nuovamente il liquido nel recipiente inferiore, basta impugnare quello superiore, come mostra questo breve filmato digitale relativo a tale esperienza. |

|
Un'altra foto proveniente dall'archivio della generosa collega Elena Ricci, che illustra un facile esperimento per identificare i buoni e i cattivi conduttori di calore. Sistemando cubetti di ghiaccio uguali su piattini di materiali differenti (compensato, ceramica, plastica, bambù, metallo) si cronometrano i tempi di scioglimento, scoprendo che il primo a sciogliersi è quello sul metallo, seguito da quello di ceramica; mentre dopo due ore quello sul compensato non è ancora completamente sciolto. Una verifica davvero intuitiva ed utile per i ragazzi di ogni età. |
 |
Ed ecco un esempio di isolamento termico all'interno di una parete di forati, ottenuta con un'apposita schiuma isolante, dotata di un bassissimo coefficiente di conducibilità termica. Un tempo si usava lana di vetro, ignifuga ed idrofoba, ottenuta dal riciclaggio del vetro e anche fonoisolante. Oggi si usano piuttosto fibra di cellulosa, che protegge anche dal caldo; oppure perlite, derivante da roccia vulcanica, idrorepellente e incombustibile; o ancora granuli di sughero tostato, che vengono dalla quercia da sughero, insensibile all'acqua e all'umidità e inattaccabile da insetti e funghi. |
 |
Altro notevole esempio di isolamento termico: i doppi vetri. Definito anche vetro camera, il vetro doppio è un insieme di due o più lastre distanziate da un telaio perimetrale con uno spessore che va da 6 a 15 mm, sul quale viene applicata una speciale colla, così che aderisca perfettamente ai vetri come una guarnizione, e che viene poi fatto passare sotto una pressa che migliora l’adesione, in modo che si crei una camera d'aria stagna, attraverso cui la conduzione del calore è bassissima. Io a casa mia ce li ho! |

|
Questo strumento è molto utile per la visualizzazione dei moti convettivi dell'acqua calda. Dall'alto si versa nel tubicino del liquido colorato contenente chicchi di riso, poi si scalda un'estremità con il fornelletto ad alcool. Il calore provoca delle variazioni di densità nel liquido e fa sì che questo si metta a circolare nel circuito; il suo moto è ben visualizzato dai chicchi di riso che l'acqua trascina con sé. Tutto ciò permette di verificare il concetto della convezione del calore. |

|
I moti convettivi nell'acqua calda però possono essere osservati anche in maniera assai semplice e naturale, semplicemente preparandosi un piatto di pasta. Infatti, dopo che si è buttata la pasta nell'acqua calda e che questa avrà cominciato a cuocere, si noterà che alla superficie si formano potenti getti d'acqua calda che spingono la pasta verso l'alto; immediatamente dopo la pasta torna a precipitare verso il basso, come mostra anche questo breve filmato digitale. La fisica in cucina... |

|
Questa immagine digitale, scattata nel salotto di casa mia il 31/12/2005, mostra un termoscopio da me costruito con materiale assai facile da reperire; un bastone di metallo tenuto diritto da un supporto, un ago fissato con la colla, una spirale di carta gialla). Esso illustra perfettamente i moti convettivi dell'aria calda: se lo si pone sul calorifero acceso, la spirale inizia a girare a causa dell'aria che sale. Eccovi anche un brevissimo filmato digitale di quest'esperienza. Consiglio a chi vuole di provare lui stesso a costruire questo strumento, scegliendo una soluzione per tenere diritto il bastoncino (un mio amico ha utilizzato un vecchio ago da calza tenuto diritto da un rocchetto di legno). |

|
Una foto piuttosto strana, che però ha molto in comune con quella precedente. « È solo un calorifero », direte voi. Vero, però sul muro sopra di esso è facile osservare i tipici baffi neri dovuti alla fuliggine, cioè alla polvere bruciata, che viene trascinata verso l'alto dai moti convettivi dell'aria calda. Analogo fenomeno si può osservare sul retro dei frigoriferi di una volta o allo sbocco dei condizionatori d'aria. |

|
Un autentico pezzo da museo: il cubo di Leslie. Si tratta di un cubo di lamiera con un foro nella parte superiore, usato per riempirlo con acqua calda. Le facce laterali del cubo sono verniciate con colori diversi: una è annerita (quella di sinistra), una bianca, una speculare e una smerigliata, in modo da variare l'emissione media di calore delle singole superfici, che è massima per il nero e minima per il bianco. Serve insomma per studiare il fenomeno dell'irraggiamento. |

|
Anche questa foto viene dalla collega Elena Ricci, ed illustra un'esperienza da lei condotta sull'irraggiamento. In pratica si prende un barattolo chiuso nel quale pesca un termometro e lo si avvolge con carta di diverso colore, quindi lo si fa investire dal fascio di luce di un faretto. Misurando l'aumento di temperatura nel barattolo e conoscendo la potenza del faretto è possibile ricavare in maniera semplice le leggi dell'irraggiamento. |

|
L'immagine qui a sinistra rappresenta una termografia del laboratorio di Energetica del Politecnico di Milano, da me stesso scattata nella primavera del 1990: sulla destra si distingue un tavolo, più caldo del resto del locale. La termografia evidenzia l'emissione infrarossa, e quindi gli oggetti più caldi appaiono rossi, i più freddi appaiono blu. |
|
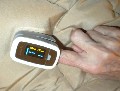
Quello che qui vedete fotografato è un esemplare di saturimetro, fotografato per gentile concessione del suo proprietario, il dr. Enzo Caronno. Si tratta di un dispositivo inventato nel 1974 dal giapponese Takuo Aoyagi per misurare la quantità di emoglobina ossigenata senza analisi chimiche. La sonda è composta da LED che generano fasci di luce infrarossa e da una fotocellula che riceve la luce dopo che i fasci hanno attraversato la cute e la circolazione del paziente. L'emoglobina legata assorbe la luce in determinate lunghezze d’onda, e da qui si ricava la saturazione dell'ossigeno nel paziente. |

|
Cosa ci fa qui una serra artigianale anziché nell'Armadio Virtuale di Botanica? Serve per illustrare il cosiddetto e famigerato effetto serra. Il vetro è trasparente ai raggi infrarossi, cioè ai raggi termici, solo se hanno una certa lunghezza d'onda. Ma i raggi solari, riflettendosi sulla superficie terrestre, aumentano la loro lunghezza d'onda, e il vetro è opaco ad essi. Così il calore resta intrappolato dentro la serra, aumentandone la temperatura. Un rischio che corre anche l'atmosfera terrestre... |

|
Questo esemplare di termopila di Moll consiste di una sonda sensibile, utilizzata per misurare la radiazione termica di un cubo di Leslie o di un modello di corpo nero. In pratica contiene una termocoppia, cioè un circuito bimetallico le cui estremità sono tenute a temperature differenti: il circuito è percorso da una debole corrente che viene misurata da un galvanometro e permette di risalire alla temperatura della radiazione che la investe (si veda anche l'Armadio Virtuale di Elettromagnetismo). |

|
Questa fotografia rappresenta un pirografo, cioè (come dice l'etimologia del suo nome) uno strumento per disegnare tramite il calore. Si tratta in pratica di una resistenza elettrica alimentata da un trasformatore da 15 V e dotata di impugnatura in plastica (che, come sappiamo, è un pessimo conduttore del calore). Scaldandosi per effetto Joule, la resistenza permette di tracciare disegni ornamentali su di una superficie in legno bruciandone letteralmente la superficie (vedi anche l'Elettromagnetismo) |

|
Un'esperienza davvero interessante è quella della misura del calore di semi che germinano. Come si vede in questa fotografia, dei semi di orzo sono stati messi a bagno in una scodella piena d'acqua e vi vengono lasciati per alcuni giorni. Misurando la temperatura dell'acqua mediante un sensore elettronico di temperatura, è facile registrare un aumento costante. |

|
Qui vedete uno straordinario giocattolino, il papero bevitore, il cui funzionamento è tutto termodinamico. Esso infatti è costituito da due cavità sferiche (testa e corpo) collegate da un tubo (il collo). La cavità inferiore è piena di cloruro di metile, un liquido molto volatile, la cui tensione di vapore dipende fortemente dalla temperatura. Il suo centro di massa è posto il perno di rotazione, quindi inizialmente è in equilibrio stabile. Bagnando il feltro che ricopre la testa, il liquido rosso comincia a salire... |

|
...perchè ora la tensione di vapore nella cavità superiore è minore di quella inferiore. La risaluta sposta verso l'alto il centro di massa, e il papero si inclina finché il suo becco tocca l'acqua nel bicchiere. Il tubetto non pesca più nella cavità inferiore, per gravità il fluido torna verso il basso, e l'oggetto recupera la posizione verticale. Poi ha di nuovo il sopravvento l'evaporazione, e il moto ricomincia. Ecco un filmato digitale che ci mostra questa sorta di moto perpetuo! |

|
La figura mostra il modellino, tuttora perfettamente funzionante, della cassetta di distribuzione in una macchina a vapore. Il vapor d'acqua prodotto dalla caldaia entra da sinistra, penetra nella parte superiore del cilindro e spinge in basso lo stantuffo. Grazie ad un abile gioco di leve, però, l'otturatore posto a sinistra si sposta e fa sì che il vapore passi nella metà inferiore, spingendo lo stantuffo verso l'alto; e così via. In tal modo il vapore produce un moto alternativo, che il sistema biella-manovella trasforma in moto circolare delle ruote della locomotiva. |

|
Ed ecco l'applicazione più comune della macchina a vapore: la locomotiva, qui fotografata il 26/2/2005 dalla mia allieva Marta Milano al Museo Nazionale della Scienza e della Tecnica di Milano, nel padiglione ferroviario. Ivi si trova ricostruita per intero una vecchia stazione ferroviaria, e vi si trovano molti esemplari di motrici ferroviarie di varie epoche. Il primissimo veicolo a ruote comandato da una macchina a vapore fu ideato dal francese Cugnot, ma la prima locomotiva su rotaie per uso civile si deve all'inglese George Stephenson (1781-1848). |

|
Qui, sempre fotografato da Marta Milano, possiamo vedere un particolare della locomotiva precedente, e cioè proprio il sistema biella-manovella illustrato semplicemente dal modellino riportato immediatamente sopra. Come si vede, la stessa manovella comanda più ruote contemporaneamente, che così si muovono tutte all'unisono. Sulla sinistra, fuori dalla fotografia, si trova la cassetta di distribuzione, funzionante in base allo stesso principio del modellino testé mostrato. |

|
Componente essenziale della locomotiva è, naturalmente, la caldaia, dove l'acqua viene portata ad ebollizione affinché il vapore possa entrare nella cassetta di distribuzione e mettere in moto le ruote. Qui vediamo spalancata la parte frontale della nostra locomotiva, e la guida in piedi accanto ad essa, intenta ad illustrarne il funzionamento. La caldaia piena d'acqua era attraversata dai tubi che portavano i fumi caldissimi, poi scaricati all'esterno mediante il tipico camino posto al di sopra della motrice. |

|
Dalla parte diametralmente opposta rispetto alla foto precedente c'era l'abitacolo del fuochista e del macchinista, qui ripreso (come la foto precedente) dall'allieva Gaia Macchi. Dentro il portellone visibile in figura, ha spiegato la guida del Museo, il fuochista scaricava badilate di carbone prelevato dal vagoncino agganciato alla motrice. Era un lavoro improbo, poiché gli addetti erano costretti a respirare tutto il fumo della fornace, specialmente dentro le gallerie. Inoltre il macchinista dove anche sporgersi per poter vedere la strada ferrata, e questi sbalzi di temperatura lo conducevano spesso alla malattia e alla morte. |

|
Qui vedete ritratto un ampio set di strumentazione per lo studio della termodinamica: matracci, bulbi, vetreria, reticelle di protezione per becchi Bunsen, persino due pentolini da far scaldare sulla fiamma. Sulla destra si riconoscono in particolare delle serpentine da utilizzare durante esperienze di distillazione. |

|
Ed ecco altri due ripiani del nostro armadio virtuale. In particolare sul ripiano inferiore all'estrema destra si riconosce un utile modellino di motore a scoppio che ho usato molte volte durante le nostre lezioni; alla sua sinistra vi è il termoscopio illustrato qui sopra . Si tratta di uno strumento di facile costruzione con materiale povero e di sicuro impatto sugli studenti. |

|
Questa fotografia, scattata dall'alunno Emanuele Ferrara (III B cl. 2005/06), illustra proprio il modellino di motore a scoppio che è ritratto in piccolo nell'immagine qui sopra. Si riconosce la valvola di ingresso (a destra), quella di efflusso (a sinistra), le valvole comandate dagli alberi a camme (ai due lati), la candela (in alto), il sistema biella-manovella (al centro). Girando una manovella posta sul retro, tutte le parti del modellino si mettono in moto in perfetto sincronismo. Una vera sciccheria! Il tutto illustra il ciclo termodinamico oggi detto ciclo Otto, che però era stato brevettato da Beau de Rochas nel 1862. |
 |
Un altro modellino, stavolta di un motore Diesel. Esso è stato messo a punto nel 1890 dall'ingegnere tedesco Rudolf Diesel (1858-1913) e differisce da quello a scoppio perchè è privo di candele. L'esplosione della miscela infatti avviene per pura compressione all'interno del cilindro, senza innesco, e ciò richiede un rapporto di compressione molto maggiore di quello del motore a scoppio, 1 a 20 contro 1 a 8. Nei Diesel moderni, per facilitare l'esplosione, si utilizzano candelette che preriscaldano la miscela. Il motore Diesel è più semplice del precedente perchè è privo di spinterogeno, ma è anche molto inquinante. |

|
Dopo i modellini, ecco un vero motore a scoppio a quattro tempi, estratto da una motofalciatrice dal mio abile allievo Davide de Alberti (III B cl. 2005/06), da lui portato in classe e rimontato sotto gli occhi miei e dei suoi compagni. Questo è il risultato finale: si vede in alto la testa del motore, in basso l'albero motore con il sistema biella-manovella e gli ingranaggi che comandano il movimento delle valvole (dal vivo erano perfettamente visibili sul lato destro). Complessivamente il tutto è alto circa mezzo metro ed applica nella pratica tecnologica il ciclo Otto, formato da due adiabatiche e due isovolumiche, e cosiddetto dal suo inventore, l'ingegnere tedesco Nikolaus August Otto (1832-1891), che presentò per la prima volta nel 1876 il primo prototipo provvisto di regolatore centrifugo e di distribuzione a valvole laterali. |

|
Ed ecco ora alcune parti di motore a scoppio, anch'esse messe a disposizione dall'allievo Davide de Alberti. Qui in particolare vediamo la camera di combustione (a sinistra) e il pistone (a destra) di un decespugliatore. La camera di combustione contiene il cilindro in cui si muove il pistone, spinto dalle quattro fasi alle quali si accennava sopra, e le opportune valvole che regolano l'afflusso della miscela e il deflusso dei gas combusti. |

|
Qui vediamo invece il pistone di un motore di automobile (le dimensioni sono assai maggiori rispetto al modello precedente), a cui è collegata la biella che permette di trasformare il moto alternativo del pistone in un moto circolare pressoché uniforme. Da notare che, su quattro fasi, l'unica attiva è quella di scoppio; per permettere la rotazione dell'albero motore a velocità uniforme si pone su di esso un volano, che con la sua elevata inerzia mantiene la velocità quasi costante, ed inoltre si realizza un motore a quattro cilindri tutti sfasati di un tempo l'uno rispetto all'altro, in modo che almeno uno di essi si trovi sempre nella fase di scoppio. |

|
Mi sembra giusto mostrare anche l'albero motore, tenuto in mano dallo stesso studente Davide de Alberti. Si noti che su di esso sono già presenti le manovelle che trasformano il moto alternativo dei pistoni in moto rotatorio, secondo il principio della biella-manovella illustrato poco sopra. Lo studente, nel corso del suo orale di Esame di Stato (la tesina era incentrata su questo argomento, la potete scaricare da qui), ci ha spiegato che questo albero motore svolge anche la funzione di albero a camme, poiché su di esso sono presenti degli ingranaggi che comandano direttamente l'apertura e chiusura sincrona delle valvole. |

|
Infine, degli accessori del motore a scoppio che farebbero una buona figura anche nell'Armadio Virtuale di Elettromagnetismo, poiché non sono altro che delle candele, apparecchi il cui scopo è quello di generare una scintilla per far esplodere la miscela di ossigeno e benzina nell'istante giusto, né prima né dopo. Se infatti la macchina rallenta e non si preme la frizione, si noterà che il motore comincia a perdere colpi, perchè le ruote rallentano l'albero motore e le valvole non sono più in sincronia con i tempi del motore. Invece il motore Diesel è privo di candele, perchè il gasolio esplode semplicemente per compressione. |

|
Ed ecco una foto d'insieme del motore di un'automobile (precisamente della FIAT Punto di proprietà del sottoscritto); i cilindri si trovano sotto il coperchio di plastica nera al centro. Sulla destra si vede invece la batteria, preposta a fornire corrente alle candele; affinché producano scintille in perfetta sincronia con le varie fasi del funzionamento del motore, interviene un componente particolare del motore chiamato spinterogeno, il cui compito è proprio quello di distribuire corrente alle candele. |

|
Questo collage è opera dell'alunno Francesco Battistella (3 G 2012/13), che il 18/05/2013 ha portato in classe il motore a scoppio a due tempi del suo ciclomotore, smontato in ogni singolo pezzo per mostrarlo ai suoi compagni. Esso si differenzia dal motore a quattro tempi perché in quest'ultimo si ha una fase attiva per ogni giro completo dell'albero, non ogni due, e perchè non ha le valvole di aspirazione e scarico, sostituite dalle "luci", ovvero fenditure non circolari ricavate direttamente sul cilindro, aperte e chiuse dal moto alternato del pistone! |
 |
La foto a fianco la dobbiamo all'amico Andrea Villa, che il 30 agosto 2020 ha visitato il Museo della Fondazione Barsanti e Matteucci a Lucca. Pochi lo sanno, ma il motore a scoppio non fu inventato nel 1876 da Nikolaus Otto, bensì nel 1854 dal sacerdote e ingegnere lucchese Padre Eugenio Barsanti (1821-1864), in collaborazione con Felice Matteucci (1808-1887). Purtroppo la Toscana del 1854 non era né l'Inghilterra né gli Stati Uniti, e la priorità della loro invenzione non venne mai riconosciuta, nonostante il loro motore fosse perfettamente funzionante. Da qui potete scaricare un breve video di Andrea che lo dimostra! |
 |
Quello che vedete a sinistra è lo spettacolare modellino di un turboreattore per aereo realizzato per l'Esame di Stato 2020/21 dal mio brillante studente Matteo Ken Bertolasi: si tratta di un motore a ciclo continuo che sfrutta il cosiddetto Ciclo Brayton per produrre la spinta necessaria a far muovere un aereo sfruttando il Terzo Principio della Dinamica. Il motore è formato da una presa d'aria, da un compressore centrifugo, dalla camera di combustione, dove si trovano gli iniettori del combustibile (cherosene), da una turbina e da un ugello di scarico che fornisce la spinta, racchiusi in un involucro metallico di forma aerodinamica posto nell'ala, di fianco alla fusoliera, oppure sulla coda. |
 |
Qui vedete il retro del modellino soprastante, parzialmente smontato. Il motore turbogetto, collaudato per la prima volta il 27 agosto 1939, e ampiamente sfruttato dopo il secondo conflitto mondiale, funziona grazie ad un compressore che invia l'aria nella camera di combustione, dove si miscela con il combustibile nebulizzato dagli iniettori ed è incendiato da una candela. La combustione continua provoca un notevole innalzamento della temperatura dell'aria che, non potendo espandersi, viene indirizzata verso la turbina dove si espande cedendo a questa la propria energia. Complimenti a Matteo per il modellino da lui realizzato, di cui cliccando qui potete anche visionare un filmato! |

|
Fondamentale in termodinamica è il concetto di entropia, introdotto dal fisico tedesco Rudolf Clausius (1822-1888) per indicare il grado di disordine di un sistema terdonimamico: è un concetto fondamentale anche nella Chimica. Fisicamente essa è definita come il rapporto tra la quantità di calore che il sistema ha scambiato con l'esterno nel corso di una sua trasformazione reversibile, e T è la temperatura assoluta alla quale è avvenuto lo scambio. La fotografia mostra le carte da gioco disposte al termine di un solitario riuscito: come in un cristallo, il grado di disordine è minimo... |

|
...se però sparigliamo tutto il mazzo, come in figura, il sistema presenta un'altissima entropia. Il secondo principio della Termodinamica può essere espresso in questi termini: nelle trasformazioni spontanee l'energia resta costante, ma l'entropia non può far altro che aumentare. i conseguenza, perché noi vediamo il vaso cadere sul pavimento e andare in cocci, ma mai i cocci ricomporsi da soli sul tavolo? Perchè la prima trasformazione aumenta il disordine e quindi l'entropia, mentre la seconda la riduce e non può assolutamente avvenire spontaneamente! |
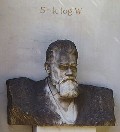
|
Questa foto rappresenta la tomba di famiglia di Ludwig Boltzmann (Vienna, 20 febbraio 1844 – Duino, 5 settembre 1906), uno dei più grandi fisici teorici di tutti i tempi, ideatore della Fisica Statistica. Purtroppo le sue idee, troppo innovative per i tempi, furono derise ed osteggiate dai colleghi, ed egli finì per suicidarsi. Sulla sua lapide, come si vede, è incisa la formula che lo ha reso universalmente famoso: S = KB x log W, la quale fornisce l'entropia S di un sistema in funzione del suo numero di microstati W, e quindi, in definitiva, del suo disordine. Le applicazioni dell'equazione di Boltzmann vanno dall'astrofisica allo studio dell'inquinamento, fino alla progettazione di reattori nucleari e semiconduttori. |
| Cliccate qui per scaricare alcune schede per realizzare molte delle esperienze di questa galleria | |
| Queste immagini possono essere liberamente utilizzate da chiunque, purché se ne citi la fonte | |
 |
 |
 |
 |
 |
 |